Figure 3.
Télécharger l'image originale
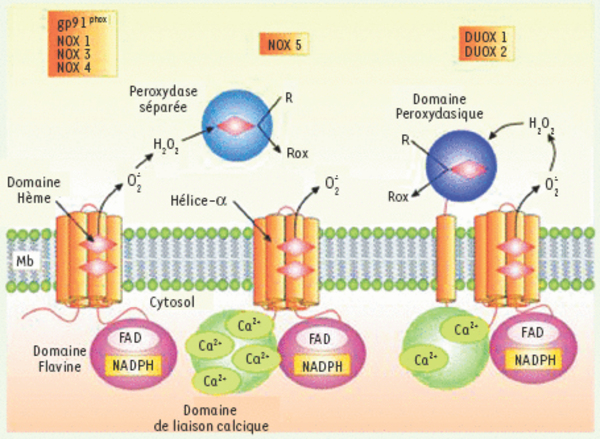
Structure des Nox et Duox. Nox-1, Nox-3 et Nox-4 sont similaires en taille et en structure à Nox-2. Elles contiennent un domaine hydrophobe aminoterminal à six hélices transmembranaires. Cette région comporte cinq résidus histidine dont quatre sont impliqués dans les liaisons aux deux hèmes. Les hèmes sont des groupements prosthétiques contenant du fer trouvé dans les enzymes, les protéines de transfert d’électrons et les pigments liant l’oxygène comme l’hémoglobine. Le fer des hèmes peut être réduit et ré-oxydé, et fonctionne comme un transporteur d’électron. Les deux hèmes sont localisées approximativement à l’intérieur de la bicouche lipidique et, ensemble, fournissent aux électrons un canal leur permettant de passer la membrane plasmique. La partie carboxyterminale de la molécule se replie pour former un domaine cytoplasmique indépendant contenant les domaines de liaison pour les co-enzymes NADPH et FAD. Les Nox catalysent la réduction de l’oxygène à partir du NADPH et du FAD en anion superoxyde. Nox-5 contient le même corps catalytique que Nox-2 mais possède en plus un domaine aminoterminal liant le Ca2+. Les Duox sont formées sur la même base structurale que Nox-5 et possède en plus, au niveau du domaine aminoterminal, une région transmembranaire suivie d’un domaine homologue aux peroxidases tel que la myéloperoxydase. Ce domaine peroxydase-like semble être extramembranaire et pourrait produire, à partir des anions superoxyde engendrés par le corps catalytique, des FRO afin d’oxyder des substrats extracellulaires (R) (d’après [10]).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




