Figure 1.
Télécharger l'image originale
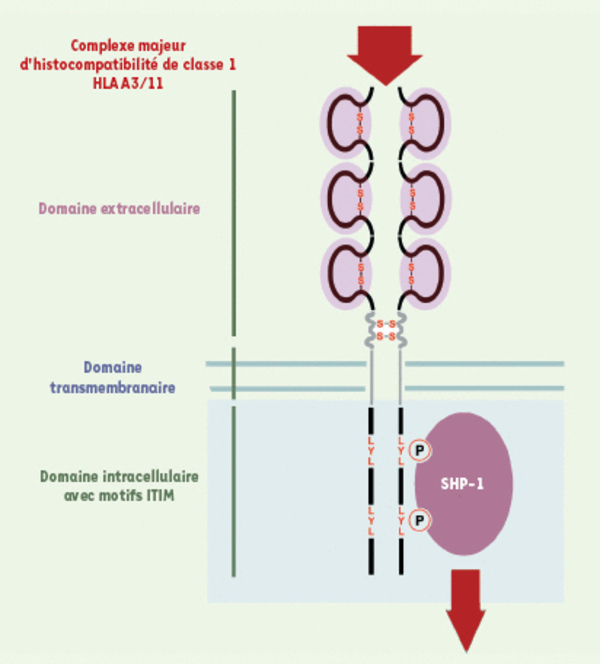
Structure de KIR3DL2. KIR3DL2/CD158k/p140 est un homodimère de p70. Chaque monomère est constitué d’une partie extracellulaire faite de trois domaines immunoglobuliniques, d’une partie transmembranaire et d’une partie longue intracytoplasmique. Concernant les lymphocytes NK, la transduction du signal implique une cascade d’événements qui ont été bien décrits. Après engagement avec son ligand physiologique (les molécules du complexe majeur d’histocompatibilité de classe I), les résidus tyrosine portés par les motifs ITIM de la portion intracellulaire du récepteur sont phosphorylés et recrutent la molécule phosphatase cytosolique SHP-1 qui va permettre la déphosphorylation des tyrosine kinases recrutées lors de l’engagement des récepteurs activateurs.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




