Figure 2.
Télécharger l'image originale
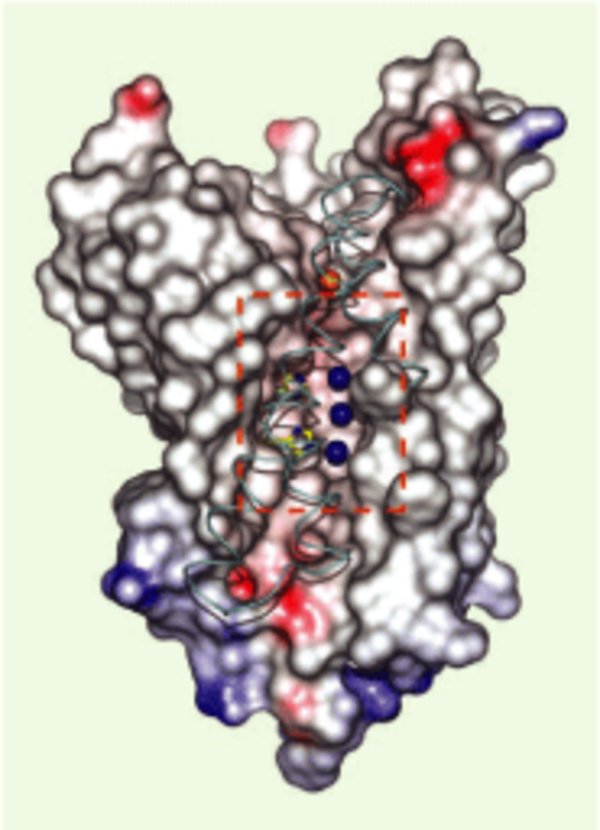
Le canal NH3 du transporteur d’ammoniaque AmtB de E. coli. L’analyse de la structure cristallographique à haute résolution (1,5 Å) du transporteur AmtB de E. coli a permis de mettre en évidence la présence dans chaque sous-unité de la protéine trimérique d’un pore central flanqué d’un vestibule plus large à l’entrée et à la sortie de la protéine [4, 5]. Le vestibule d’entrée est bordé par des acides aminés aromatiques (W148, F103, F107) qui stabilisent l’ion ammonium NH4+ (sphère orange) et permettent sa déprotonation. Le pore hydrophobe étroit (20 Å de long, cadre pointillé rouge) contient deux résidus d’histidine (en jaune, positions 168 et 318) qui stabilisent trois molécules de NH3 (sphères bleues) grâce à des liaisons hydrogène au cours de leur passage à travers le canal. Dans le vestibule de sortie, sur la face cytoplasmique, il y a retour à l’équilibre entre les formes neutres (NH3) et chargées (NH4+) (d’après [4] avec la permission de Science).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




