Figure 2.
Télécharger l'image originale
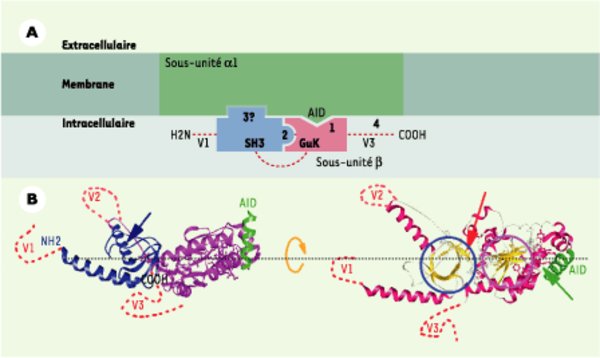
Structure tridimensionnelle de la sous-unité β. A. Schéma représentant les interactions intra- et intermoléculaires entre le canal et les sous-unités β déduit d’expériences de mutagenèse, de biochimie et d’électrophysiologie. Le site primaire d’interaction (1) entre ces deux sous-unités est constitué sur le canal de l’AID et sur la sous-unité β du BID/C2. Cet ancrage pourrait nécessiter une interaction intramoléculaire (2) entre les domaines SH3 et GK retrouvés sur toutes les sous-unités β. Une interaction entre le domaine SH3 et le canal a également été proposée (3) [15]. Enfin, des sites d’interaction secondaires spécifiques de chacune des sous-unités β existent dans les parties variables (4).B. Structure tridimensionnelle de la sous-unité β déduite des données de cristallographie. Partie gauche : les parties variables V1, V2 et V3 qui n’ont pu être cristallisées sont schématisées en pointillé. Les deux domaines SH3 et GK sont visibles en bleu et rose, l’AID, partie du canal interagissant avec la sous-unité β et cocristallisée, est visible en vert. Le BID, séquence qui semble plus importante pour l’intégralité structurale de la sous-unité que pour son interaction directe avec le canal, comme cela avait été initialement proposé, est distinguée par la représentation en bâtonnet de ses acides aminés. La deuxième hélice du domaine SH3 qui occupe le site de fixation des partenaires polyproline est identifiée par la flèche bleue (d’après [16], protein data base accession number : 1T3L). On peut noter le confinement de la zone d’interaction avec le canal, laissant libre une large surface de la sous-unité pour d’autres interactions. Partie droite : même structure, mais avec une symbolisation colorée de la structure secondaire : feuillet β en jaune et hélice α en rouge (à l’exception de l’AID en vert). Les cercles bleu et rose isolent les cœurs en feuillets β des domaines SH3 et GK respectivement. La flèche rouge signale le 5e feuillet du domaine SH3 appartenant à la région C2 et constitué du début de la séquence BID. La flèche verte montre la partie du BID qui participe aux interactions avec le canal (AID en vert). La stabilité de ces interactions nécessite l’intégralité du domaine C2. Cette structure a subi une légère rotation autour d’un axe horizontal par rapport à celle de la partie gauche.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




