Figure 1.
Télécharger l'image originale
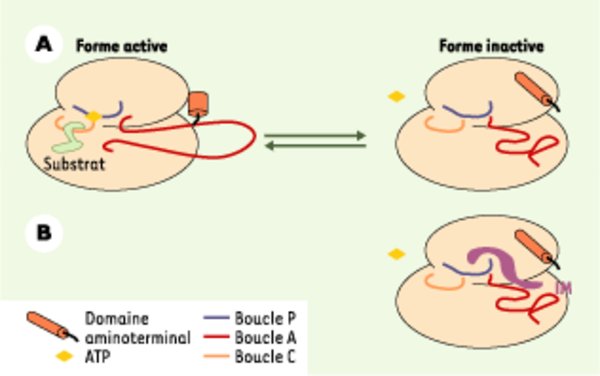
Représentation tridimensionnelle du site actif de c-abl. Trois boucles fonctionnelles ont été modélisées : une boucle C, correspondant au site catalytique de la TK, une boucle P (phosphate binding loop), qui structure le site de fixation de l’ATP et dans laquelle se lie l’IM, et une boucle d’activation A, dont la conformation dépend de son statut de phosphorylation. Le domaine très conservé aminoterminal de la protéine représente un élément essentiel dans l’auto-inhibition de la TK. Cette région, très riche en hélices alpha, interagit avec la boucle A et permet sa stabilisation sous forme active. A. Equilibre physiologique entre la forme active de la molécule et la forme inactive. Lorsque la boucle A présente un statut phosphorylé, sa conformation « ouverte » stable permet une grande accessibilité du site catalytique aux molécules d’ATP. La TK c-abl est alors sous forme active. En revanche, lorsque la boucle A présente un statut déphosphorylé, sa conformation spécifique rend l’accès du site catalytique aux substrats difficile. La protéine c-abl présente alors une conformation inactive qui n’est pas similaire à celles que l’on peut observer pour d’autres TK. B. Interaction entre une molécule d’imatinib mésylate (IM) et c-abl. La conformation de la boucle A joue un rôle majeur dans l’affinité de la TK pour son substrat. Elle est le siège de la spécificité de l’IM, car cette dernière reconnaît la conformation inactive très particulière de c-abl.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




