Figure 2.
Télécharger l'image originale
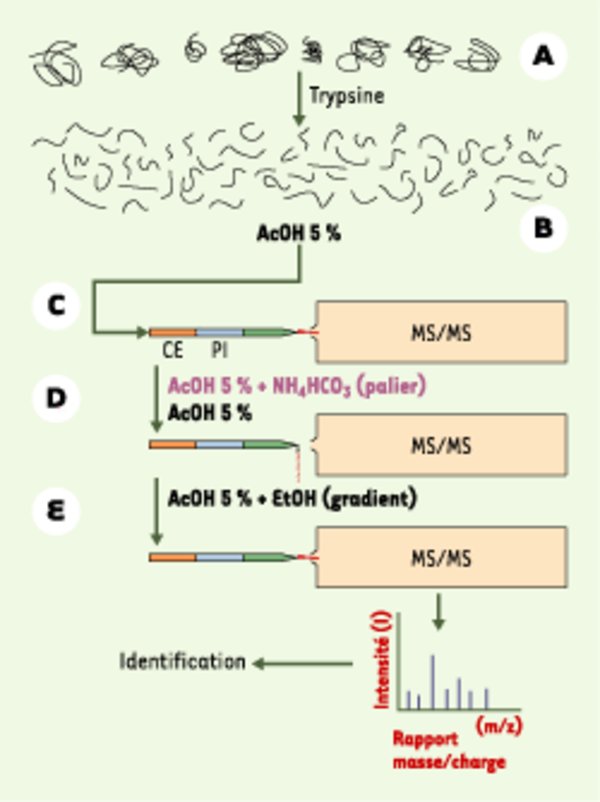
Analyse d’un mélange de protéines par la méthode MUDPIT (multidimensional protein identification technology). A. Le mélange de protéines est directement digéré par la trypsine. B. Le mélange complexe de peptides résultant de cette digestion est ensuite acidifié avec de l’acide acétique (AcOH). C. Le mélange est déposé sur un système composé de deux colonnes chromatographiques en tandem, relié à un spectromètre de masse (MS) en tandem : la première colonne est un échangeur fort de cations (CE), la deuxième une phase inverse (PI). D. L’élution de la colonne échangeuse d’ions par une concentration donnée de sels (NH4HCO3) transfère une partie des peptides vers la colonne de phase inverse. E. Après lavage pour éliminer le sel, la colonne de phase inverse est développée par un gradient d’éthanol (EtOH, 1 heure), et les peptides sortant de la colonne sont analysés par spectrométrie de masse en tandem, ce qui permet de déterminer leur nature, et donc la protéine dont ils proviennent. Une fois l’élution terminée, une étape de salinité plus importante est appliquée pour transférer d’autres peptides vers la colonne de phase inverse ; une vingtaine de ces cycles sont réalisés.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




