Figure 1.
Télécharger l'image originale
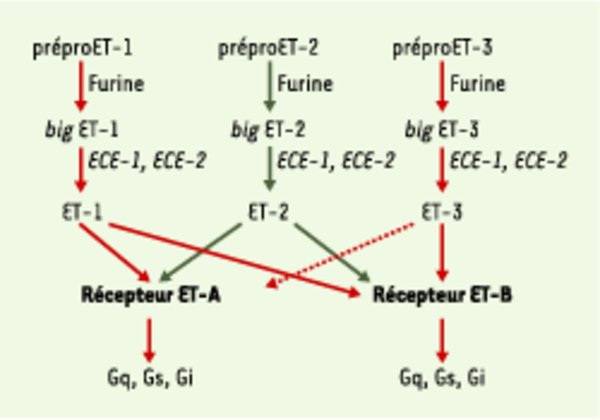
Genèse des endothélines. Les précurseurs des endothélines sont clivés par deux groupes de protéases pour produire les endothélines matures et actives. Les préproendothélines (prépro ET-1, -2, -3) constituées d’environ 200 résidus sont clivés au niveau de sites dibasiques par des endopeptidases de type furine pour former des intermédiaires biologiquement inactifs appelés big endothélines (big ET-1, 2, 3) qui sont des peptides de 37 à 41 acides aminés. Les big endothélines sont ensuite clivées au niveau de la liaison Trp-Val de la big ET-1 et de la big ET-2 ou au niveau de la liaison Trp-Ile de la big ET-3 pour former le peptide final de 21 acides aminés (ET-1, 2). Cette dernière étape est effectuée par des métalloprotéases membranaires à zinc de la superfamille des néprilysines [3], appelées enzymes de conversion de l’endothéline (ECE-1, 2). Les peptides endothélines (ET-1, 2, 3) produits interagissent de manière sélective avec le récepteur ET-A et de manière non sélective avec le récepteur ET-B. Ces deux récepteurs sont couplés à des protéines G variées (Gq, Gs, Gi) permettant différentes réponses physiologiques. L’affinité du récepteur ET-A pour les peptides ET-1 et ET-2 est de l’ordre de la nanomole (flèches en trait plein) et celle pour ET-3 est plus faible de deux ordres de grandeur (flèche en trait pointillé). En revanche, le récepteur ET-B a la même affinité pour les trois peptides (de l’ordre de la nanomole).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




