Figure 1.
Télécharger l'image originale
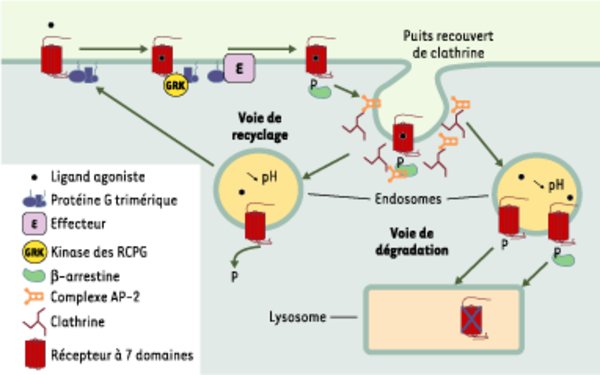
Endocytose des récepteurs à sept domaines transmembranaires couplés aux protéines G (RCPG) après une activation de courte durée : mécanisme principal et devenir des récepteurs internalisés. Lorsque le ligand se lie à un récepteur, ce dernier interagit avec une protéine G trimérique qui se dissocie en sous-unités α-GTP et βγ, capables d’activer des effecteurs cellulaires (E). Très rapidement les RCPG sont phosphorylés par des kinases spécifiques (GRK) et cette phosphorylation a pour effet d’augmenter l’affinité pour la β-arrestine. La liaison de la β-arrestine sur les RCPG favorise leur entrée dans la voie d’endocytose via les puits recouverts de clathrine. En effet, la β-arrestine interagit avec la sous-unité β d’AP-2 et cette protéine adaptatrice établit un pont moléculaire entre le complexe récepteur-β-arrestine et la principale protéine du manteau de la vésicule d’endocytose, la clathrine. Une fois le compartiment endosomique atteint, le devenir des récepteurs internalisés est variable. Le plus souvent, les récepteurs sont déphosphorylés et recyclés vers la membrane plasmique, où ils peuvent à nouveau être stimulés. Du fait de spécificités de structure propres, certains récepteurs ne recyclent pas et sont dirigés vers le compartiment lysosomial pour y être dégradés. Les mécanismes moléculaires qui dirigent les récepteurs vers les lysosomes semblent multiples, incluant une forte affinité pour les β-arrestines, l’ubiquitinylation de la région cytoplasmique, ou l’association avec des protéines de tri.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




