Figure 1.
Télécharger l'image originale
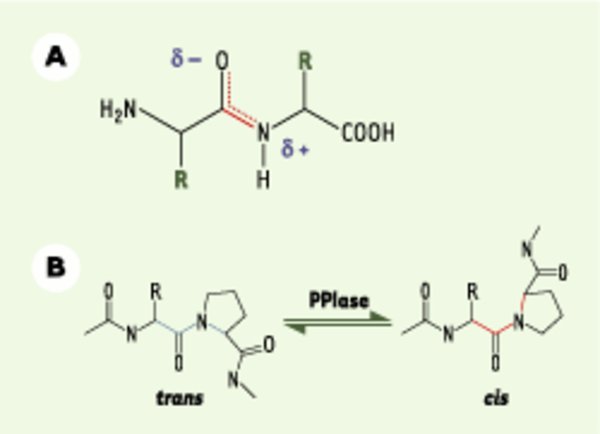
Changement conformationnel catalysé par les peptidyl-prolyl isomérases. A. Dans les protéines, la liaison peptidique se retrouve presque exclusivement en conformation trans. L’encombrement stérique des chaînes latérales des acides aminés (R) explique en partie cette préférence. Le caractère de liaison double de la liaison carbone-azote, causé par la délocalisation électronique du groupement carbonyle et donc à la formation d’un hybride de résonance, explique pourquoi la liaison est figée dans une des deux conformations. La liaison peptidique ne permettant pas de rotation libre, le passage d’une conformation à l’autre ne se fait que très lentement. B. Les peptidyl-prolyl isomérases (PPIases) provoquent une isomérisation du lien peptidyl-prolyl d’une conformation cis à trans, et inversement, ce qui aboutit à un changement d’orientation de la chaîne peptidique dans l’espace.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




