Figure 4.
Télécharger l'image originale
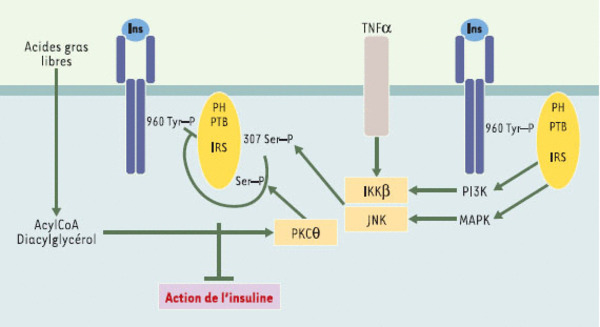
Inhibition du signal insuline par phosphorylation sur Ser/Thr des proteines IRS. Cette phosphorylation peut résulter d’un rétrocontrôle du signal insuline, ou de l’action d’autres agents comme le TNFα (tumor necrosis factor α) et les acides gras libres, mais aussi de l’IL (interleukine) 1β, et même l’insuline. La kinase IKK β (inhibitor of nuclear factor κB kinase), la MAP-kinase et surtout la Jun kinase (JNK) sont capables d’effectuer de telles phosphorylations. En phosphorylant la sérine 307 de l’IRS1 murin, la JNK empêche l’interaction du domaine PTB de IRS1/2 avec la tyrosine 960 phosphorylée du RI et donc la transmission du signal insulinique. Cette kinase est activée par l’insuline et par le TNFα. Par ailleurs, l’élévation des acides gras libres et l’accumulation de diacylglycérol et d’acylCoA pourraient conduire à une activation de la PKC θ et à une phosphorylation de l’IRS1 sur Ser/Thr.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




