Figure 4.
Télécharger l'image originale
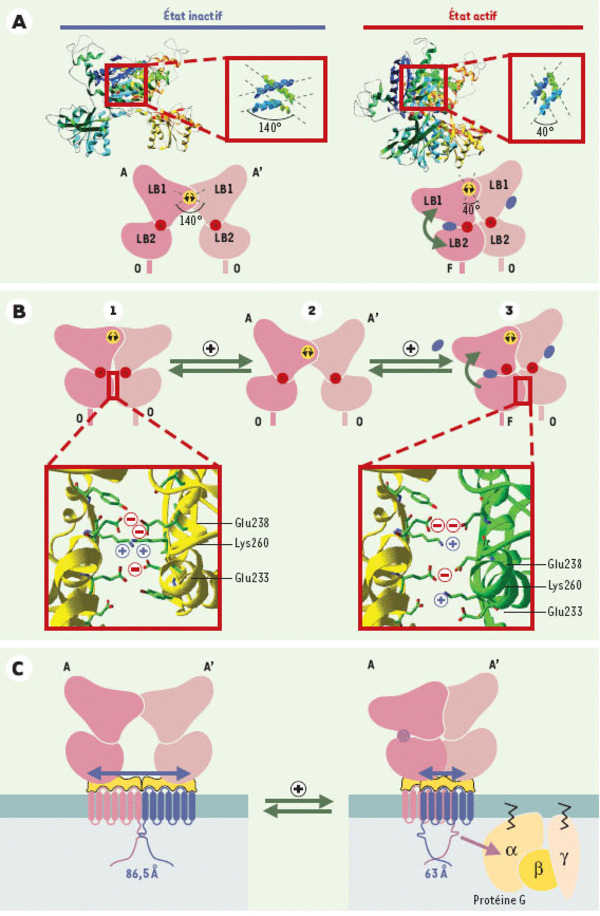
Importance de la dimérisation dans le mécanisme d’activation du récepteur mGlu1. A. En haut, est représentée la structure tridimensionnelle du dimère de domaines Venus flytrap dans l’état inactif (pdb: 1ewt, à gauche) et dans l’état actif, en présence de glutamate (pdb: 1ewk, à droite). Dans les deux cas, l’encadré rouge montre un agrandissement de la zone de contact des lobes 1 (LB1). Cette interface est constituée de deux hélices pour chaque protomère (hélices bleues pour le protomère A et vertes pour le protomère A’). Le passage à l’état activé est caractérisé par un fort changement de l’orientation relative des deux protomères. En bas, le pivotement d’un domaine Venus flytrap par rapport à l’autre est schématisé. Dans ce modèle, la fermeture d’un seul protomère est suffisante pour déclencher le changement conformationnel. O: conformation ouverte; F: conformation fermée. B. Rôle de l’interface de contact des lobes 2 (LB2). Le pivotement au niveau de l’interface des deux lobes 1 (LB1) illustré en A s’accompagne de la création d’une nouvelle zone de contact entre les deux lobes 2. Ce contact n’est stable, et ne peut donc exister, que si l’un des domaines Venus flytrap est fermé. Les encadrés rouges détaillent les interactions moléculaires ayant lieu à cette interface. La conformation nº1 est un modèle construit en faisant pivoter « manuellement » deux protomères ouverts autour de l’axe de rotation du lobe 1, de manière à mettre artificiellement en contact les lobes 2. L’interface ainsi créée met face à face des résidus de même charge, ce qui est très défavorable thermodynamiquement et explique pourquoi la probabilité d’existence d’une conformation active réalisée à partir de deux domaines Venus flytrap ouverts est faible. En revanche, dans le cas de figure réel nº3, la charge positive de la lysine 260 neutralise en partie la charge du glutamate 238. C. Le pivotement des domaines flytrap a pour conséquence le rapprochement de leurs extrémités carboxy-terminales auxquelles sont rattachés les domaines heptahélices (en bleu) via le domaine riche en cystéines (en jaune). Ce rapprochement pourrait être à l’origine du changement conformationnel des domaines heptahélices, lui-même à l’origine de l’activation des protéines G.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




