Figure 3.
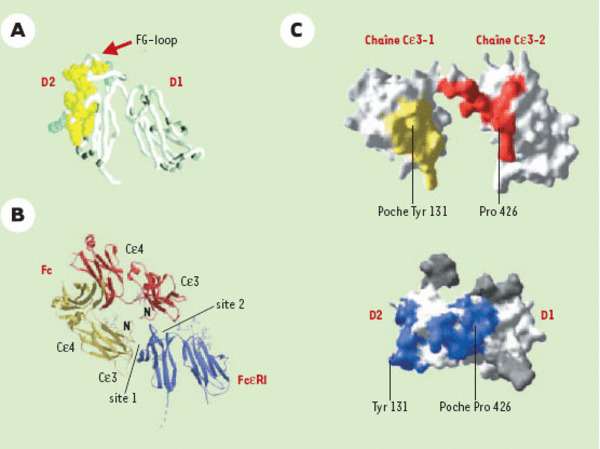
Caractéristiques de la structure tridimensionnelle du FcεRIαet du complexe Cε3-Cε4/FcεRIα. A. Structure tridimensionnelle modélisée du FcεRIα montrant l’angle aigu en V inversé formé par les deux domaines apparentés à la superfamille des Ig (D1 et D2). Les résidus identifiés, par des études de mutagenèse, comme étant impliqués dans la liaison à l’IgE sont représentés en jaune et en bleu. Les sites d’attachement des hydrates de carbone apparaissent en gris. Ils se trouvent tous en dehors de la région formant le site de liaison potentiel. B. Structure tridimensionnelle du complexe montrant que le Cε3-Cε4 se lie sur deux sites distincts (site 1 et site 2) du FcεRIα L’IgE est représentée en jaune et en rouge, le récepteur en bleu. C. Représentation de la surface des deux domaines Cε3 et du FcεRIα Les résidus qui deviennent inaccessibles après formation du complexe sont représentés en jaune (site 1) ou en rouge (site 2) dans Cε3. Dans le FcεRIα la tyrosine Y131 (site 1) et la poche pour la proline P426 (site 2) sont représentées en bleu. Les résidus d’hydrates de carbone sont en gris. (Reproduit de Nature [9], avec la permission de MacMillan Publishers Ltd et de Cell [20] avec la permission d’Elsevier Science).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




