Figure 2A.
Télécharger l'image originale
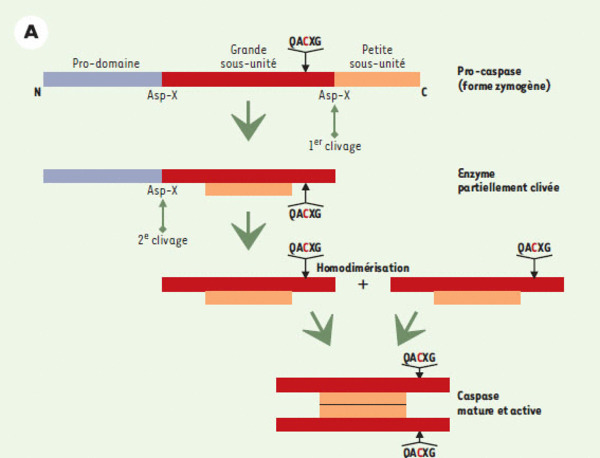
Activation des caspases. Dans leur forme inactive (zymogène), ces enzymes sont constituées d’un prodomaine, d’une grande sous-unité (portant le site catalytique) et d’une petite sous-unité. Leur clivage en deux étapes successives, libérant d’abord la petite sous-unité puis la grande, conduit à la formation de la forme active de l’enzyme : deux hétérodimères composés chacun de l’association des deux sous-unités, et comprenant donc deux sites catalytiques.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




