Figure 2
Télécharger l'image originale
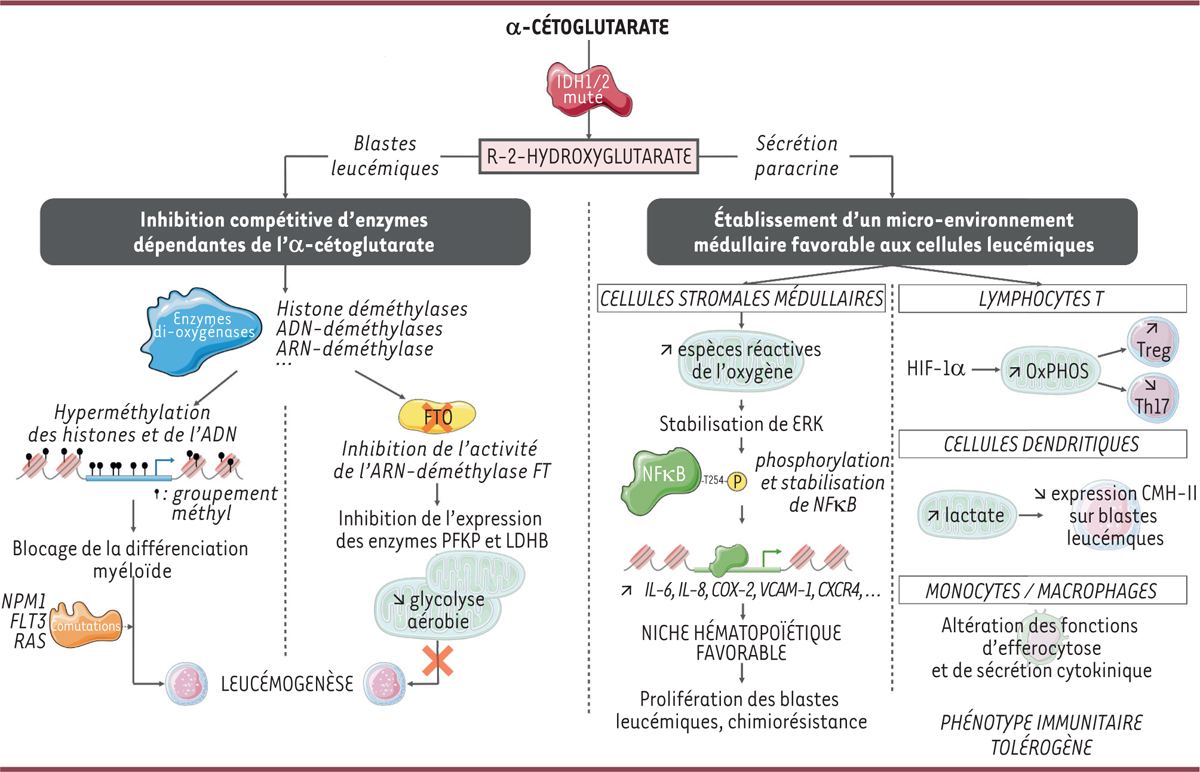
Rôle de l’oncométabolite R-2-hydroxyglutarate dans les LAM avec mutation IDH1 ou IDH2. Le R-2-HG est responsable de l’inhibition compétitive d’enzymes di-oxygénases régulant l’état épigénétique cellulaire. L’hyperméthylation induite des histones et de nombreux promoteurs conduit au blocage de la différenciation myéloïde. La coopération des enzymes IDH1/2 mutées avec des protéines fréquemment mutées dans les LAM favorise le processus de leucémogenèse. Des résultats contradictoires ont cependant été rapportés. L’inhibition de la di-oxygénase FTO, une ARN-dé mé thylase dépendante de l’α-CG, inhibe l’expression des enzymes PFKP et LDHB et ainsi, la glycolyse aérobie. Par ce mé canisme, le R-2-HG entrave la progression des cellules leucé miques IDH1/2mut et favorise leur apoptose. Via une sécrétion paracrine, le R-2-HG favorise également l’établissement d’un micro-environnement médullaire favorable à la progression leucémique. En activant la voie NFκB dans les cellules stromales de la moelle osseuse via les espèces réactives de l’oxygène, le R-2-HG facilite l’expression de cytokines pro-tumorales et de molécules d’adhésion, créant ainsi une niche de soutien pour les cellules blastiques. Le R-2-HG induit également un phénotype immunitaire tolérogène en inhibant l’expression par les blastes des molécules CMH de classe II, en facilitant la différenciation des lymphocytes T régulateurs, et en altérant les fonctions les lymphocytes T effecteurs et des macrophages. CMH : complexe majeur d’histocompatibilité. IDH : isocitrate déshydrogénase. OxPHOS : phosphorylation oxydative.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




