Figure 2.
Télécharger l'image originale
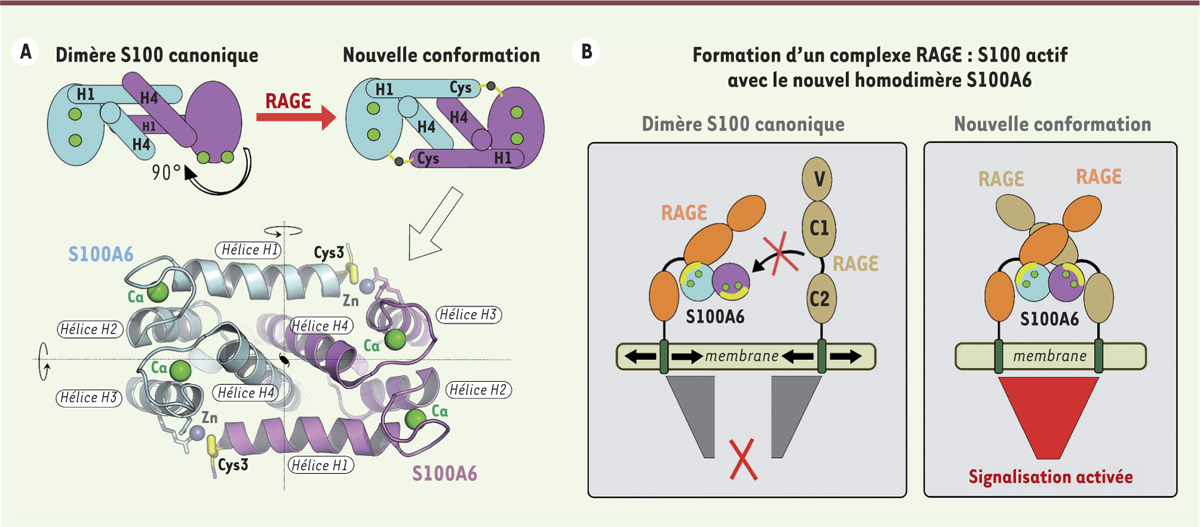
Une nouvelle conformation pour l’homodimère S100A6 stabilisée par un mécanisme cystéine-dépendant. A. Représentation schématique de la conformation homodimérique canonique des protéines S100 (à gauche) et de la nouvelle conformation obtenue pour l’homodimère S100A6 en présence de RAGE (à droite). Les ronds verts indiquent la position des sites de liaison du calcium. La nouvelle conformation homodimérique pour la protéine S100A6 humaine, observée dans la structure cristallographique du complexe RAGE:S100A6 déterminée à 2,4 Å de résolution [7], est représentée en-dessous du schéma. Cette conformation est stabilisée par la présence de deux ions Zn2+ qui sont coordonnés de manière symétrique par la cystéine (Cys) N-terminale de l’un des monomères et par une arginine et un aspartate du monomère opposé. B. Modèle illustrant comment la nouvelle conformation du dimère S100A6 permet de recruter deux molécules de récepteur parallèlement à la membrane et de bloquer la position relative de leurs régions transmembranaires à une distance qui semble compatible avec le recrutement de molécules effectrices à l’intérieur des cellules. Le site de liaison à RAGE sur chaque monomère S100A6 est indiqué par un arc jaune tandis que les ions calcium sont représentés par des ronds verts. RAGE : receptor for advanced glycation end-products.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




