Figure 1.
Télécharger l'image originale
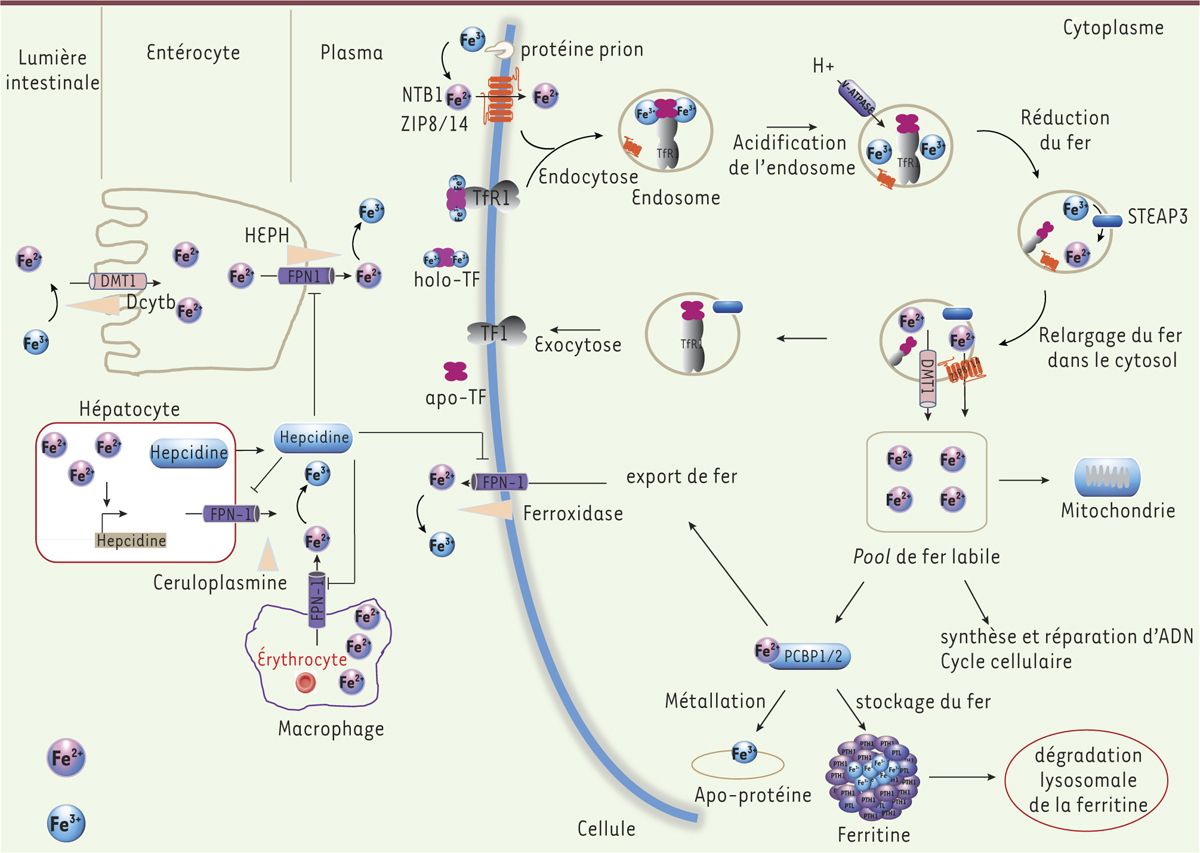
Schéma simplifié de l’absorption du fer et de son homéostasie. Les entérocytes absorbent le fer alimentaire grâce à l’action combinée de réductases ferriques, telles que le duodénal cytochrome b (Dcytb) et DMT1 (divalent metal [ion] transporter 1)/Nramp2. Le fer ferreux repris par les entérocytes est exporté dans la circulation sanguine par la ferroportine (FPN-1). Simultanément, le Fe2+ est oxydé en Fe3+ par l’héphaestine (HEPH), qui est fonctionnellement associée à la FPN-1. Dans la circulation sanguine, le Fe3+ est chargé sur l’apotransferrine (Apo-TF) pour générer la forme holotransferrine (holo-TF) associée au fer. L’holo-TF est captée par les récepteurs de la transferrine (TFR1) en fonction des besoins des différents organes et tissus. Le complexe TFR1-TF - (Fe3+)2 est endocytosé et le fer est libéré de la TF. Fe3+ est réduit par la réductase ferrique steap3 (six transmembrane epithelial antigen of the prostate 3), Fe2 + est ensuite transporté vers le cytosol par DMT1 pour former le pool de fer labile cytosolique (labile iron pool ou LIP). Des transporteurs ZIP8/14 (ZRT/IRTike protein 8/14) sont également impliqués dans le transport du fer par la protéine NTBI (non-transferrine bound iron) après réduction de NTBI par la protéine prion. Dans l’endosome, Fe2+ peut également être transporté vers le cytosol par ZIP8/14. Le LIP ainsi formé est utilisé pour divers besoins de la mitochondrie et de la cellule tels que la synthèse de l’ADN, de l’hème et la biogenèse des centres Fe-S. L’excès de fer est stocké par la ferritine ou exporté dans la circulation sanguine par FPN-1 et une ferroxidase associée. Le fer Fe2+ du milieu intracellulaire vers le plasma est oxydé en fer Fe3+, également par la céruloplasmine plasmatique à la sortie des macrophages ou des hépatocytes. Les protéines chaperonnes PCBP1 et PCBP2 (Poly-[rC]-binding protein 1 / 2) se lient au fer et le fournissent à des protéines (apo-protéines) qui nécessitent du fer non hémique comme cofacteur, comme le hypoxia-inducible factor (HIF) prolyl, les hydroxylases (métallation) à la ferritine pour le stockage, et à la DPN-1 pour son exportation. En réponse à un excès de fer circulant, l’hépatocyte synthétise l’hepcidine (HAMP), régulant ainsi négativement le fer. La HAMP induite par l’excès de fer bloque celui-ci dans différents types cellulaires comme les macrophages qui contiennent de grandes quantités de fer issues du recyclage érythrocytaire, les entérocytes, les hépatocytes, en se liant à FPN-1 entraînant son internalisation et sa dégradation. Il en résulte une rétention de fer à l’intérieur des cellules et une diminution du fer plasmatique.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




