Figure 2.
Télécharger l'image originale
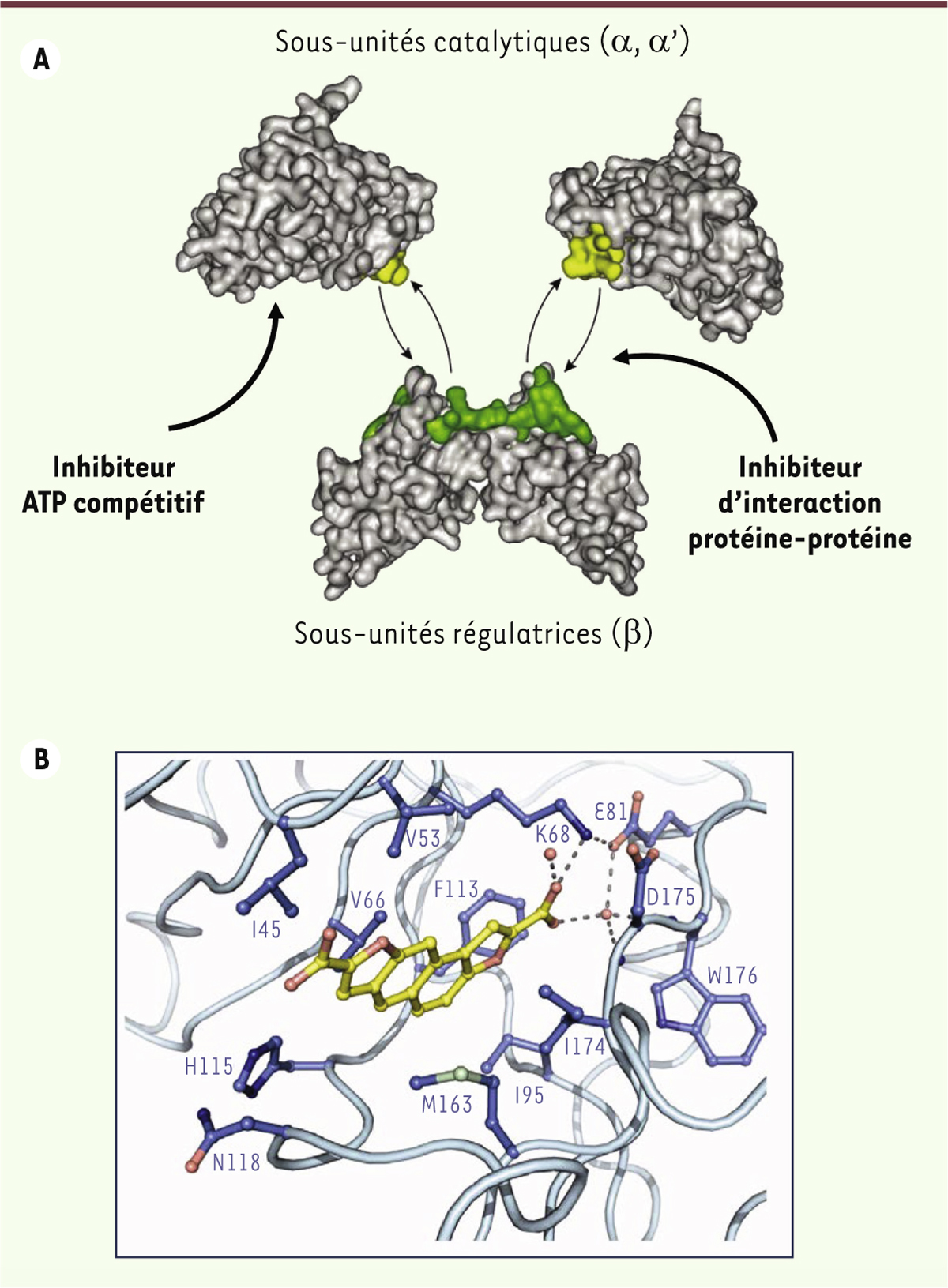
Structure de l’holoenzyme CK2. A. CK2 est un complexe moléculaire formé par l’association réversible de deux sous-unités catalytiques a/a’ avec un dimère de sous-unités régulatrices b. Le criblage de diverses chimiothèques a permis d’identifier plusieurs familles d’inhibiteurs ciblant le site catalytique sur a/a’ (ATP compétitifs) ou l’interface entre les 2 sous-unités (voir Tableau I ). Les deux types d’inhibiteurs devraient avoir des effets différents sur l’activité de CK2 : les inhibiteurs ATP compétitifs affectent la phosphorylation de tous les substrats de la kinase, alors que les antagonistes de l’interaction entre ses sous-unités perturbent spécifiquement les substrats dont la phosphorylation dépend de cette interaction protéine-protéine. B. Structure du site catalytique de CK2a en présence d’un inhibiteur ATP compétitif (l’acide 2,8-difurandicarboxylique). La structure plane et le groupement carboxyle de cette molécule lui permettent de s’insérer dans le site de liaison de l’ATP pour y former une liaison forte avec la lysine catalytique (K68).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




