Figure 2
Télécharger l'image originale
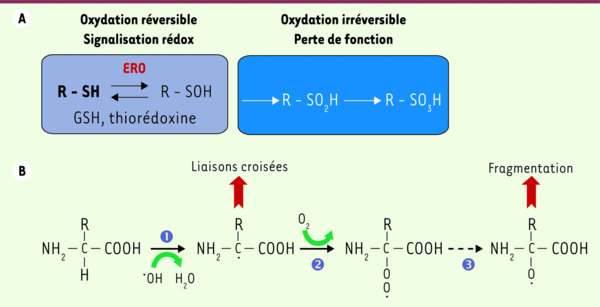
Attaque radicalaire des protéines. A. Oxydation des fonctions thiols de la cystéine. Les résidus cystéines peuvent être oxydés en acide sulfénique (R-SOH), puis en acide sulfinique (R-SO2H) et sulfonique (R-SO3H). Alors que les acides sulfiniques et sulfoniques sont stables et que leur oxydation est irréversible, la formation d’acide sulfénique est réversible sous l’action du glutathion et/ou de la thiorédoxine. B. Oxydation de la chaîne polypeptidique. 1. L’oxydation est initiée par le radical hydroxyle qui enlève un atome d’hydrogène sur le carbone alpha d’une liaison peptidique en donnant naissance à un radical centré sur le carbone. En l’absence d’oxygène, deux radicaux centrés sur le carbone peuvent réagir ensemble pour former des liaisons croisées intra ou interchaînes. 2. En présence d’oxygène, une réaction d’addition a lieu pour former un radical peroxyle. 3. Après une série de réactions complètes, un radical alkoxyle est formé, étape nécessaire à la fragmentation de la chaîne polypeptidique (d’après [11])
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




