Figure 1
Télécharger l'image originale
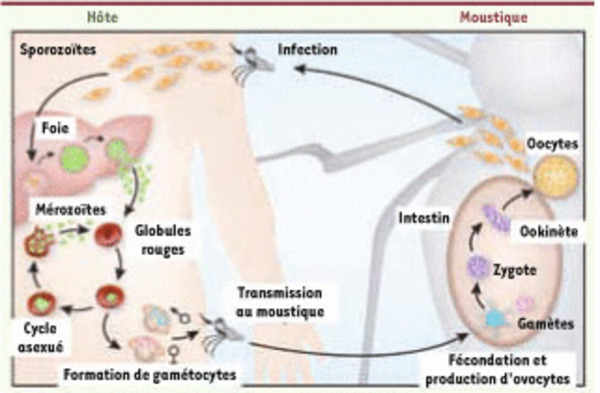
Comment la diversité génétique de l’hôte humain peut influer sur la transmission du Plasmodium au vecteur. L’anophèle femelle transmet les sporozoïtes P. falciparum à l’hôte. Après leur maturation dans le foie, les mérozoïtes sont relargués dans la circulation ; ils colonisent les globules rouges au cours du cycle asexué ; les gamétocytes mâles et femelles sont produits via la gamétogenèse. Lors de son repas sanguin, un moustique ingère des gamètocytes, qui, dans son intestin, formeront des macro (femelles) ou micro (mâles)gamètes. Après leur fécondation, un ookinète est produit, qui traverse la paroi intestinale et génère des oocystes contenant des sporozoïtes, facilement reconnaissables après la dissection du moustique. Certaines hemoglobinopathies sont associées à une protection de l’hôte vis-à-vis de l’infection par P. falciparum. Mais ces variants HBB provoquent aussi une transmission accrue des parasites de l’hôte vers le moustique. En présence de mutants HBB, HbC ou HbS, le cycle asexué s’épuiserait plus rapidement et la gamétogenèse serait plus précoce. Le prélèvement de ces globules rouges par l’anophèle accélérerait ainsi le développement du cycle sexué chez le vecteur, et la possibilité de réinfection à l’occasion d’une nouvelle piqûre (adapté de [14]).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




