Figure 3.
Télécharger l'image originale
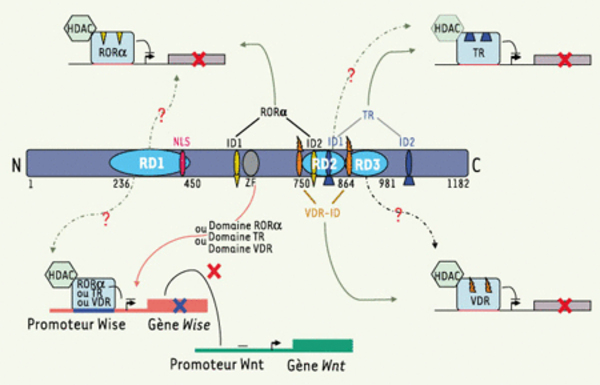
Structure de la protéine Hairless. Chez la souris, la protéine Hairless (HR) est composée de 1 182 acides aminés et présente une masse moléculaire de 127 kDa. Morphologiquement, la protéine Hairless ne possède pas de motifs structuraux distinctifs, à l’exception d’une séquence putative à doigt de zinc entre les acides aminés 590 et 625 (ZF). La protéine Hairless se localise dans le noyau, grâce à une séquence signal de localisation nucléaire bipartite (NLS, nuclear localisation signal), située entre les acides aminés 409 et 427. Des domaines d’interaction avec des récepteurs nucléaires d’hormones ont été identifiés dans la protéine Hairless de rat qui présente 95 % d’identité avec celle de la souris : les domaines d’interaction avec les récepteurs nucléaires de l’hormone thyroïdienne (TR) sont situés entre les acides aminés 750 et 864 (TR-ID1) et les acides aminés 980 et 1 084 (TR-ID2) ; la région située entre les acides aminés 750 et 864 comprend également le domaine d’interaction avec le récepteur de la vitamine D (VDR-ID), ainsi que les motifs LXXLL capables d’interagir avec le récepteur α-orphelin des rétinoïdes (RORα-ID). La protéine Hairless serait un corépresseur ; des analyses fonctionnelles ont révélé l’existence de trois domaines de répression, RD1, RD2, RD3, situés entre les acides aminés 236 et 450, 750 et 864, et 864 et 980, respectivement. La protéine HR est également capable de réguler la voie Wnt en réprimant le gène Wise, un inhibiteur de la voie Wnt.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




