Figure 1.
Télécharger l'image originale
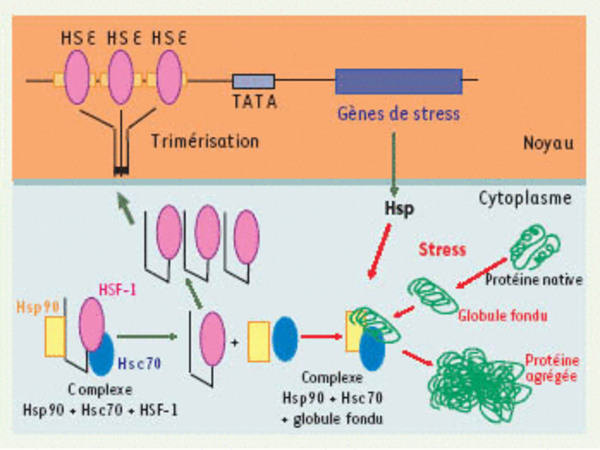
Activation transcriptionnelle des gènes codant pour les Hsp. Les protéines présentent plusieurs états de repliement. Entre la forme native et l’état agrégé, il existe des états intermédiaires comme les structures du type globule fondu (molten globule). Dans des conditions de choc thermique, la concentration en globules fondus augmente de manière significative. Les globules fondus sont reconnus par Hsc70 et Hsp90, des protéines chaperons résidentes de la cellule non stressée ; le complexe formé entre Hsp90, Hsc70 et les globules fondus est plus stable que celui que formaient dans la cellule non stressée ces Hsp avec le facteur de transcription HSF-1. Celui-ci est alors modifié (phosphorylation, trimérisation) et migre dans le noyau où il interagit avec les motifs HSE (heat shock element) localisés dans les promoteurs des gènes codant pour les Hsp. La grande quantité de Hsp produite permet de replier les globules fondus, et d’agir négativement sur HSF-1 (heat shock transcription factor-1) en le maintenant à nouveau inactif dans le cytoplame, ce qui explique la réversibilité du phénomène.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




