Figure 3.
Télécharger l'image originale
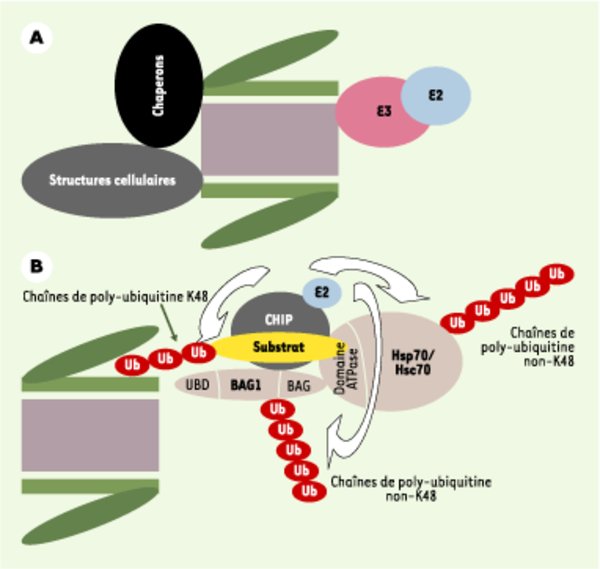
Engagement du protéasome dans des complexes supramoléculaires.A. Interactions du protéasome avec d’autres composants de la cellule. Le protéasome peut interagir avec des enzymes d’ubiquitinylation et des chaperons moléculaires, mais aussi avec diverses structures cellulaires comme les systèmes de translocation qui permettent d’extraire les protéines du réticulum endoplasmique. B. Interactions complexes entre le protéasome, des chaperons moléculaires, des enzymes d’ubiquitinylation et des molécules adaptatrices. Cet exemple montre comment des interactions moléculaires complexes peuvent stimuler la dégradation de substrats ubiquitinylés par le protéasome. CHIP (carboxy terminus of Hsp70-interacting protein) est un cochaperon qui interagit avec les protéines chaperons de la famille Hsp70/Hsc70 (protéines de choc thermique inductible/constitutive). Elle possède une activité E3 permettant la formation de différents types de chaînes de poly-ubiquitine. En interagissant avec le domaine ATPase de Hsp70/Hsc70, elle inhibe le recyclage de substrats par ces chaperons. De façon concomitante, elle stimule l’ubiquitinylation par des chaînes K48 des protéines à dégrader par une E2 qui lui est associée. Par ailleurs, elle interagit avec une protéine adaptatrice, Bag1 (Bcl2-associated athanogene), qui se lie au complexe régulateur 19S grâce à un domaine UBD. Cette interaction, qui est capitale pour le maintien du supercomplexe, favorise aussi le transfert du substrat ubiquitinylé au protéasome via la conjugaison de chaînes non-K48 sur Bag1. Parallèment, CHIP stimule également la formation de chaînes non-K48 sur Hsp70/Hsc70. Ni la manière dont l’ubiquitinylation de Bag1 stimule la dégradation des protéines substrats, ni la raison de l’ubiquitinylation de Hsp70/Hsc70 ne sont élucidées.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




