Figure 2.
Télécharger l'image originale
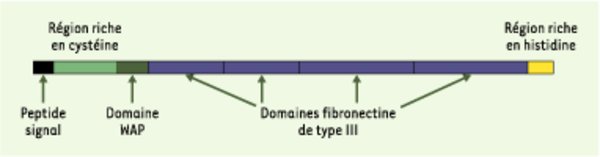
Structure de l’anosmine-1. L’anosmine-1 est une protéine de la matrice extracellulaire. Elle est présente localement, dans divers tissus, pendant la période de l’organogenèse. Son absence est à l’origine de la forme liée au chromosome X du syndrome de Kallmann De Morsier. Elle comporte une région aminoterminale riche en résidus cystéine, au sein de laquelle on identifie un domaine d’environ 50 acides aminés, d’abord mis en évidence dans la protéine acide du petit lait ou whey acidic protein (WAP), et conservé dans toutes les protéines orthologues de l’anosmine-1 humaine connues à ce jour, y compris chez les invertébrés. Ce motif est également présent dans plusieurs petites protéines sécrétées qui ont une activité inhibitrice de protéases à sérine, mais une telle activité demeure hypothétique pour l’anosmine-1 (comme d’ailleurs pour la protéine WAP). Le reste de la protéine comprend quatre domaines semblables aux motifs répétés de type III de la fibronectine, suivis par un court fragment carboxyterminal riche en acides aminés basiques et en histidine. L’anosmine-1 se lie aux glycosaminoglycannes du type héparane sulfate, ce qui suggère qu’elle participe à la signalisation par les facteurs FGF.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




