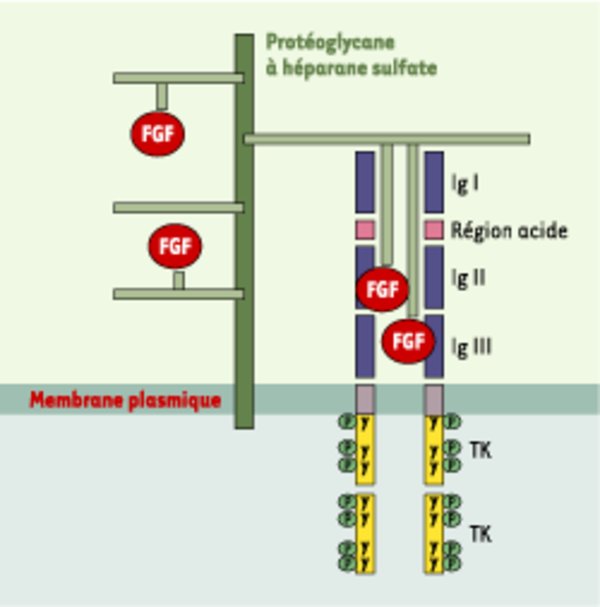
Figure 1.
Télécharger l'image originale
Activation de FGFR1 par ses ligands FGF en présence de protéoglycanes à héparane sulfate. FGFR1 est un récepteur membranaire actif sous forme de dimère, les monomères étant inactifs. La région extracellulaire, qui fixe le ligand FGF, comporte trois domaines de type immunoglobuline (IgI, IgII et IgIII). Entre les deux premiers s’intercale un module très riche en résidus acides (région acide), dont le rôle serait d’empêcher l’activation spontanée du récepteur en l’absence de son ligand [33]. La région intracellulaire comprend deux domaines à activité tyrosine kinase (TK). La formation d’un complexe moléculaire tripartite entre FGF, FGFR et la chaîne héparane sulfate d’un protéoglycanne est nécessaire à la dimérisation du récepteur, qui est suivie de son activation par autophosphorylation (P) de résidus tyrosine (Y) dans la région intracellulaire de la molécule. Les phosphotyrosines stimulent en retour l’activité tyrosine kinase du récepteur ou servent de points d’ancrage à des molécules de la cascade de signalisation.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




