Figure 1.
Télécharger l'image originale
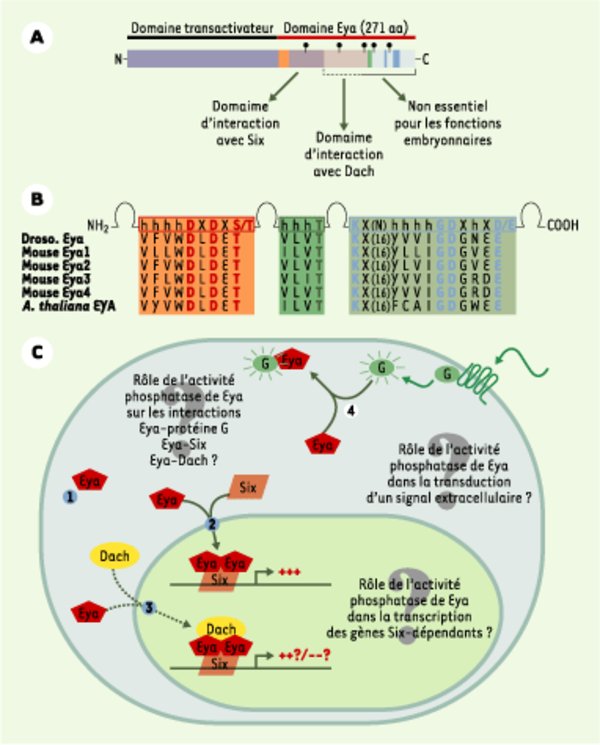
Structure et fonction de la protéine Eya. A. Représentation schématique des différents domaines fonctionnels des protéines Eya. Le domaine aminoterminal est responsable de l’activité transcriptionnelle, alors que le domaine carboxyterminal participe aux interactions avec les partenaires protéiques (Six, Dach, protéines G). Les 271 aa carboxyterminaux sont particulièrement bien conservés au sein de la famille Eya et définissent un domaine protéique particulier nommé domaine Eya. C’est dans cette région qu’a été identifié le site catalytique tyrosine phosphatase (rectangles orange, vert et bleu). Pour indication, quelques sites de mutations ponctuelles identifiées chez les patients BOR ont été reportés sur la figure (balises noires). B. Séquence des trois motifs caractérisant les enzymes HAD (haloacid dehalogenase hydrolases). Les aa colorés sont identiques dans toutes les protéines Eya et constituent la signature biochimique des enzymes HAD. C. Modèle résumant les interactions protéiques connues entre Eya et ses partenaires. 1. Eya, seul, reste localisé dans le cytoplasme ; 2. En présence d’homéoprotéine Six, Eya est transloquée dans le noyau, où le complexe Six-Eya fonctionne en synergie pour activer la transcription de gènes cibles : la protéine Six permet l’ancrage du complexe à l’ADN au niveau de séquences spécifiques et Eya active fortement la transcription des gènes cibles. 3. Eya peut également interagir avec Dach, mais le rôle activateur et/ou répresseur de ce troisième partenaire transcriptionnel est encore controversé. Le complexe Six-Eya-Dach est stabilisé par la protéine CBP. 4. Eya est capable d’interagir avec les petites protéines Galphai et GalphaZ monomériques activées ; cette interaction retient Eya à la membrane plasmique et suggère que Eya participe à la transduction d’un signal extracellulaire, encore non identifié. La découverte de l’activité tyrosine phosphatase de Eya amène à reconsidérer ces interactions protéiques sous un nouvel angle, puisque chaque partenaire pourrait également être un substrat de Eya. Enfin, il est très tentant, mais également très spéculatif à ce jour, d’imaginer un modèle où Eya jouerait un rôle d’interrupteur, permettant d’allumer ou d’éteindre l’expression de gènes en réponse à un signal extra-cellulaire : l’activation de la transcription ne serait possible que dans les cellules exprimant les protéines Six qui permettent la translocation nucléaire de Eya et son ancrage à l’ADN ; en revanche, la présence d’un signal extra-cellulaire faisant intervenir l’activation des protéines Galphai et GalphaZ monomériques inhiberait la transcription des gènes cibles en maintenant Eya au niveau de la membrane plasmique.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




