Figure 1.
Télécharger l'image originale
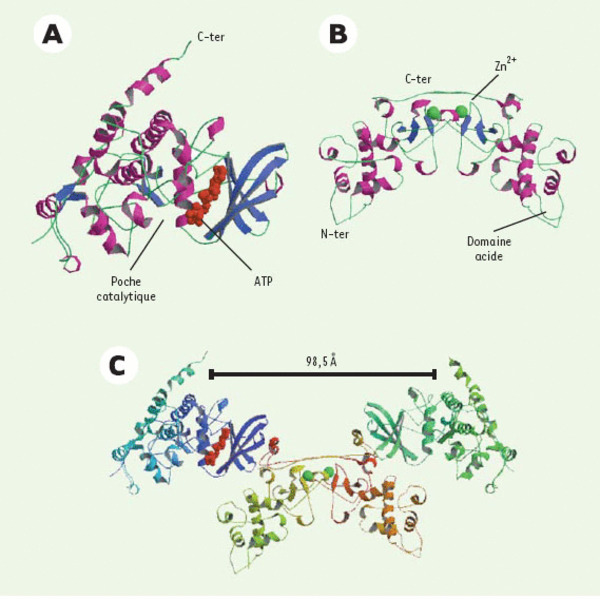
La protéine kinase CK2 à l’échelle atomique. La structure de la sous-unité catalytique (A) révèle la conformation spontanément ouverte de la poche catalytique située entre les deux lobes de la protéine kinase, et rend compte de son activité « constitutive » (adapté de [2]). La structure de la sous-unité régulatrice (B) révèle l’existence d’un domaine extrêmement acide et d’un motif en doigt de zinc responsable de la dimérisation de la protéine. Le dimère ainsi formé présente une large surface accessible pour des interactions avec ses nombreux partenaires. L’extrémité carboxy-terminale de la protéine n’est pas visible sur cette structure (adapté de [3]). La structure de l’holoenzyme (C) montre que les deux sous-unités catalytiques n’interagissent pas entre elles. Une région discrète de nature hydrophobe, située au niveau des feuillets β du lobe supérieur de la sous-unité catalytique, interagit avec le domaine carboxy-terminal des deux sous-unités régulatrices. Le caractère flexible de l’interface sous-unité α/sous-unité β suggère que l’holoenzyme est un hétérocomplexe transitoire dont la formation est probablement contrôlée dans la cellule (adapté de [6]).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




