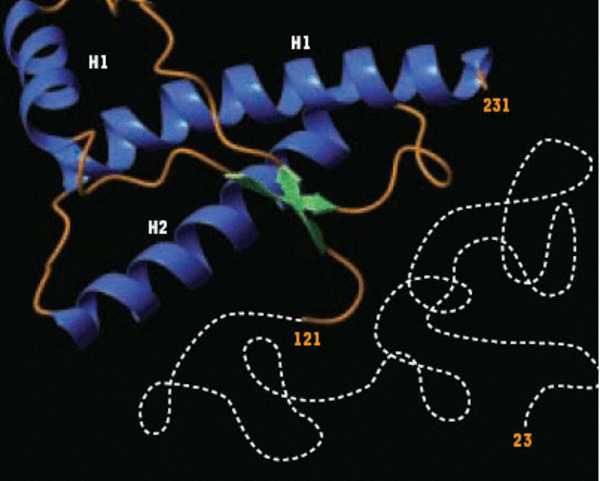
Figure 2.
Télécharger l'image originale
Représentation schématique de la structure tridimensionnelle de la protéine prion normale recombinante de hamster. La molécule est formée d’une chaîne polypeptidique repliée de 110 acides aminés (résidus 121 à 231) qui présente trois hélices α (en bleu) et deux petits feuillets ß anti-parallèles (en vert). Les boucles de connexion sont représentées en orange. Alors que l’extrémité C-terminale de la protéine est structurée, la partie N-terminale (résidus 23 à 121) est mobile (ligne blanche pointillée). Aucune structure définie n’est observée en RMN.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




