Figure 6.
Télécharger l'image originale
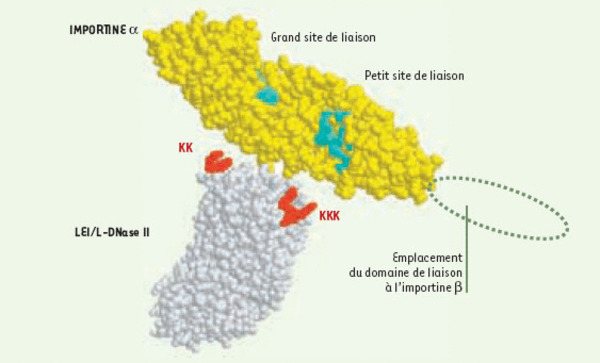
Reconnaissance de la LEI/L-DNase-II par une karyophérine (importine) alpha. La karyophérine α et la LEI/L-DNase II sont disposées de façon à montrer leur probable interaction via leurs séquences de reconnaissance spécifiques : les lysines basiques portées par la LEI sont reconnues sur l’importine par des sites de liaison riches en résidus acides. Le site le plus large est censé reconnaître le triplet de lysines tandis que le plus petit est censé reconnaître le doublet. La séquence non conservée reliant les 2 groupes basiques participe également à la liaison par l’intermédiaire de sa chaîne principale liant des résidus conservés sur l’importine. Notons qu’il s’agit d’une importine α de levure1 amputée en amino-terminal de son domaine régulateur IBB (importin β binding). Celui-ci, en absence d’importine ß, se referme sur le grand site de reconnaissance. L’importine ß, en déplaçant cette liaison, rend ce site accessible aux signaux et restaure l’affinité de l’importine α pour ceux-ci. C’est elle qui adresse au noyau ce complexe trimérique en reconnaissant le complexe de pore nucléaire.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




