Figure 4.
Télécharger l'image originale
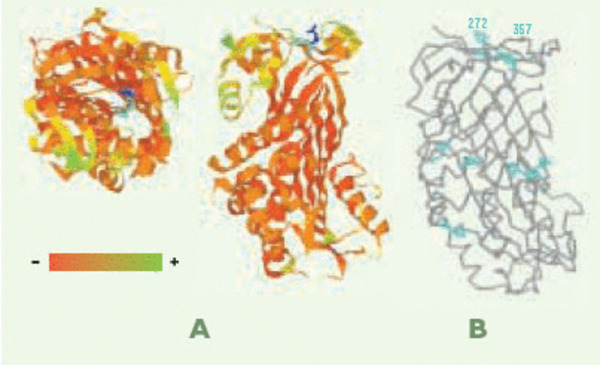
Le site actif présumé de la LDNase II. A. La comparaison des séquences de plusieurs DNases a conduit à considérer l’histidine 357 (bleu turquoise) et l’acide aspartique 356 (bleu foncé) comme des résidus présumés du site actif de la LDNase II. On remarquera leur position sur la structure tridimensionnelle de la molécule, au sein d’une dépression entourée de résidus chargés positivement susceptibles de se lier à l’ADN : le dégradé indique la couleur en fonction de la charge. B. Position des 7 histidines de la LEI de cheval sur sa structure tridimensionnelle (Code d’accès PDB : 1HLE).
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




