| Numéro |
Med Sci (Paris)
Volume 41, Numéro 1, Janvier 2025
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 79 - 82 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024196 | |
| Publié en ligne | 31 janvier 2025 | |
Garde ton sang-froid ! Comment inhiber la production post-mortem de GHB endogène ?
Keep cool! How to inhibit post-mortem production of endogenous GHB?
1
Master 1 Humanités médicales, FSMPM, Aix Marseille Université, Marseille, France
a
sarah.hadhoum@gmail.com
b
baranger.elisa@gmail.com
c
ma.ausseil@gmail.com
d
maevakahn.pro@gmail.com
Dans le cadre de l’UE « Méthodologie et travail en mode projet » proposé par le Master humanités médicales de la faculté sciences médicales et paramédicales de l’université Aix-Marseille, les étudiants de Master 1 ont été confrontés aux exigences de l’écriture scientifique.
Le Master est construit autour de la pluridisciplinarité et de l’interdisciplinarité, ce qui en fait sa force et son originalité. L’homme est repositionné dans un cadre diachronique et synchronique dans son environnement biologique, écologique, culturel au centre des problématiques de santé publique. Le défi des étudiants a été de choisir des thèmes de science en apportant la coloration sciences humaines et sociales (SHS) qui caractérise leur formation.
Ces nouvelles représentent l’association synergique des SHS et du monde de la santé en mettant en avant certains enjeux sociétaux actuels et futurs tels que les addictions de différentes natures (comportementales ou biologiques), les problématiques éthiques et déontologiques (recherche biomédicale), les épidémies et les maladies du passé (peste, typhus, anémie, etc.) pour répondre aux enjeux de santé publique actuels.
© 2025 médecine/sciences – Inserm
L’actualité scientifique vue par les étudiants du Master « Humanités médicales » de la faculté sciences médicales et paramédicales, Aix-Marseille Université

Équipe pédagogique
Responsables de l’Unité d’Enseignement :
Caroline Costedoat, Maître de Conférences HDR, Aix-Marseille Université Emeline Verna, Maître de Conférences, Aix-Marseille Université
Série coordonnée par Claire Deligne et Sophie Sibéril
L’acide 4-hydroxybutanoïque, ou γ-hydroxybutyrate (GHB), est un neurotransmetteur naturellement présent dans le cerveau des mammifères [1]. La molécule, synthétisée en laboratoire dans les années 1960 [1], a par ailleurs été utilisée longtemps comme anesthésiant, puis délaissée à cause de ses effets indésirables [1-3]. De nos jours, elle est utilisée dans le cadre de traitements expérimentaux ou, de façon illicite, comme drogue récréative [3]. Dans les années 2000, de nombreux pays l’ont classifiée comme psychotrope, et en ont interdit la production, la possession ainsi que la distribution, sauf dans un cadre thérapeutique. Elle provoque, entre autres effets, amnésie et sédation, d’où son implication fréquente dans des cas d’agression sexuelle (Figure 1) [1, 3, 4]. Déterminer l’origine du GHB présent chez la victime d’une agression est ainsi devenu un enjeu majeur dans les procédures judiciaires, car la production post-mortem, le métabolisme et l’excrétion rapides du GHB compliquent l’analyse. En effet, la durée de vie du GHB est d’environ 6 à 8 heures dans le sang, et jusqu’à 12 heures dans les urines [1, 2], un délai au-delà duquel il est peu probable d’en retrouver la trace. La détermination de sa concentration exacte en contexte médico-légal se révèle donc être cruciale. Charunyanont et al. [5] se sont intéressés à l’impact de la réfrigération corporelle précédant l’autopsie sur le taux sanguin de GHB.
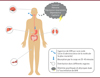 |
Figure 1. Effets corporels et psychiques de la consommation de GHB. |
Production du GHB ante- et post-mortem
Notre organisme synthétise du GHB (GHB endogène) dans le système nerveux central par différentes voies métaboliques (Figure 2). La molécule a pour précurseur métabolique principal l’acide γ-aminobutyrique (GABA) [1, 4, 6]. Il existe d’autres précurseurs, comme le γ-butyrolactone (GBL) et le 1,4-butanediol, qui sont également présents dans le cerveau [1]. Le GHB est présent dans tous les fluides et tissus contenant de l’eau : sang, urine, humeur vitrée de l’œil, cheveux, salive, lait maternel, ou encore tissu cérébral [1-4, 6, 7]. Sa demi-vie est de 20 à 60 min [2, 3, 5]. La détection de GHB est encadrée par des valeurs seuils en fonction de sa localisation : concentration d’environ 4 mg/L dans le sang et d’environ 10 mg/L dans les urines [1]. Toutefois, ces valeurs peuvent varier au cours de la vie, par exemple, lors d’une grossesse [3], ou dans le cas d’une maladie métabolique, l’acidurie, où la concentration de GHB peut varier de 100 à 200 mg/L dans le sang et jusqu’à 30 mg/L dans les urines (Figure 2).
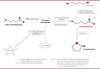 |
Figure 2. Voies de synthèse du GHB. |
Paradoxalement, la production endogène post-mortem de GHB a tendance à augmenter dans le corps pendant les 72 heures qui suivent le décès [2]. Sous l’action de micro-organismes et d’enzymes, l’autolyse cellulaire débute et le corps entre en décomposition. La conversion enzymatique du GABA en GHB induit l’augmentation de la quantité de GHB, dont la concentration dans le sang peut atteindre 50 mg/L chez un individu n’ayant jamais ingéré la molécule [1, 3, 4, 6, 7]. Cette hausse post-mortem complexifie la distinction entre le GHB produit naturellement par le corps putréfié et le GHB issu d’une administration exogène de la molécule précédant la mort. Plusieurs facteurs peuvent influer sur la production endogène post-mortem de GHB dans les tissus en cours de décomposition, comme l’environnement du corps, son état, le temps écoulé depuis la mort, ou les conditions dans lesquelles le corps est conservé [1-6]. Nishimura a montré que la dénaturation thermique des tissus inhibe la conversion enzymatique des précurseurs et donc la production de GHB [8].
Malgré la connaissance de l’existence de ces influences, aucune recherche n’avait été menée concernant l’effet du stockage des cadavres avant l’autopsie sur la production endogène post-mortem de GHB.
L’effet de la réfrigération corporelle
Malgré l’omniprésence de la réfrigération des corps humains en voie d’expertise, l’article de Charunyanont et al. [5], publié en 2022, est le premier à s’intéresser aux effets de la température de conservation du corps sur la production endogène post-mortem de GHB. Une seule étude portant sur ce facteur avait été menée précédemment sur des rats [9]. Pour réaliser la présente étude [5], les chercheurs ont réuni des échantillons provenant de 41 adultes thaïlandais concernés par une analyse judiciaire, avec des caractéristiques individuelles connues (sexe biologique, âge, cause du décès). L’intervalle de temps écoulé entre le décès et la prise en charge des corps à la morgue (et donc leur réfrigération) variait entre les sujets. Pour tous ces individus, la consommation de GHB était exclue des causes du décès. Les corps en décomposition, quant à eux, n’ont pas été inclus dans le corpus étudié afin d’éviter un biais d’interprétation des résultats causé par la putréfaction. Les sujets de l’étude ont été répartis en deux groupes, A et B, correspondant aux temps de réfrigération des corps jusqu’à l’autopsie, respectivement inférieur et supérieur à dix heures, l’autopsie étant l’étape, dans les conditions réelles d’une investigation médico-légale, pendant laquelle l’échantillon sanguin qui permet de déterminer le taux de GHB de la victime est prélevé. Trois prélèvements de sang total ont été effectués sur chaque corps. Le premier dès l’arrivée du corps du défunt à la morgue (temps T0), le second après quatre heures de conservation du corps en milieu réfrigéré (temps T4), et le dernier au cours de l’autopsie (temps TAU). Seule cette dernière étape présente une différence entre les deux groupes. Chaque échantillon de sang a été congelé à une température de – 20 °C avec du fluorure de sodium afin de minimiser la production in vitro de GHB jusqu’à son analyse.
L’étude a permis d’apporter des réponses claires concernant l’impact de la réfrigération corporelle sur la production endogène post-mortem de GHB. Notons que le sexe et l’âge des individus ne sont pas des facteurs influant significativement sur cette production. La mesure des températures corporelles à T0 et T4 n’a par ailleurs révélé aucune différence notable entre les groupes A et B, comme attendu. Les valeurs moyennes des concentrations de GHB à ces deux temps ne présentaient aucun écart entre les deux groupes, contrairement à TAU, où les taux entre les deux groupes présentaient une différence minime, avec une concentration de GHB dans le sang de 8,2 mg/L en moyenne pour le groupe A, et de 9,8 mg/L en moyenne pour le groupe B. La seule variable significative expliquant les différences de sécrétion de GHB endogène entre les individus, quel que soit le groupe (A ou B) auquel ils appartiennent était le temps écoulé entre le décès et la prise en charge des corps à la morgue, et donc leur réfrigération. En effet, une forte corrélation entre ce temps et les concentrations de GHB endogène a été constatée : les sujets pour lesquels les temps écoulés entre leur décès et la réfrigération de leur corps étaient les plus longs avaient, en moyenne, des taux de GHB endogène supérieurs.
Ainsi, il apparaît que ni les temps de réfrigération des corps, ni leur température, avant l’autopsie, n’ont d’impact sur la production endogène post-mortem de GHB. Le seul facteur ayant une influence est le temps écoulé entre le décès de l’individu et la prise en charge de son corps à la morgue qui, en fonction de sa durée, impacte plus ou moins cette production. Un prélèvement et une congélation précoce des échantillons, ainsi que l’utilisation d’un agent de conservation, sont donc conseillés pour l’obtention de résultats plus fiables. Certaines études ont montré par ailleurs que la concentration sanguine de GHB variait entre différentes populations en fonction de leurs habitudes alimentaires, du climat et des modes de conservation des corps en contexte médico-légal [5]. Il serait donc intéressant de multiplier les études de ce type sur des échantillons populationnels différents afin d’établir des mesures seuils spécifiques de chaque contexte.
Limites des dosages de la molécule GHB
Le GHB est utilisé de façon contrôlée à des fins médicales, notamment dans le traitement de l’insomnie ou le sevrage alcoolique. Dans les cas de narcolepsie et cataplexie, des troubles du sommeil, son utilisation permet de réduire les réveils nocturnes [1-4, 6, 7]. Cependant, son usage a rapidement été détourné à des fins récréatives, notamment dans le cadre de pratiques de musculation car le GHB favorise la libération d’hormone de croissance et donc l’augmentation de la masse musculaire. Le GHB est surtout connu dans le cadre d’agressions sexuelles, où il est consommé par la victime à son insu. Selon les doses absorbées, il peut avoir des effets euphorisants, induire une sensation de bien-être, mais il peut également provoquer une excitation du système nerveux central, une augmentation des mouvements oculaires, une bradycardie, ou encore une dépression respiratoire (Figure 1) [1].
L’utilisation, dans un contexte judiciaire, des valeurs de la concentration de GHB dans le sang, dans l’urine, ou dans d’autres fluides corporels se heurte à certaines limites d’interprétation. En effet, la production endogène post-mortem de GHB est susceptible de varier sous l’effet de plusieurs facteurs : la prise ante-mortem de médicaments antiépileptiques [1, 10], le régime alimentaire de la victime [1, 10], notamment si elle est atteinte d’un diabète sucré, mais aussi selon la nature et la quantité des conservateurs utilisés dans les échantillons prélevés post-mortem [1, 3], ou encore selon le degré de putréfaction des corps, inévitable et imprévisible. Enfin, les valeurs de concentration de GHB dépendent également de la zone anatomique de prélèvement de l’échantillon. Il est donc important de multiplier les études dans des environnements différents pour tenter d’établir des « normes » relatives à chaque contexte. Notons également que le sang n’est pas le seul support permettant d’observer le taux de production de GHB endogène [1, 3, 6]. La concentration de GHB endogène est plus stable dans l’humeur vitrée de l’œil que dans le sang, et sa valeur est plus élevée dans le liquide cérébro-spinal, qui subirait moins de contamination bactérienne post-mortem que le sang et l’urine [1]. L’inactivation complète des enzymes cérébrales peut être obtenue par irradiation du corps au moment du décès, une pratique qui aurait l’intérêt d’empêcher la production endogène post-mortem de GHB [1]. Toutefois, les prélèvements dans les tissus cérébraux doivent être effectués moins de 48 heures après la mort de l’individu pour garantir leur fiabilité. Il est fondamental de prendre en compte le fait qu’un prélèvement unique, que ce soit dans le sang, l’urine ou l’humeur vitrée de l’œil, ne suffit pas, et que le sang est aseptique uniquement avant la mort. De ce fait, prendre en compte toutes ces caractéristiques permet d’interpréter les valeurs de concentration mesurées le plus justement possible.
Conclusion et perspectives
L’étude de Charunyanont et al. [5] montre l’importance d’effectuer une réfrigération du corps le plus vite possible après la mort d’un individu. En effet, cela permet de faciliter la détection de certaines drogues comme le GHB lors de l’autopsie. La connaissance des propriétés fonctionnelles et métaboliques de la molécule, notamment de sa présence naturelle dans l’organisme ante- et post-mortem, est très importante dans la détermination d’un effet poison en fonction des quantités détectées et des informations culturelles, sociales, médicales qui peuvent être connues concernant la victime d’une agression. Ainsi, l’étude présentée ici a montré les limites des dosages toxicologiques post-mortem et la nécessité de poursuivre leur cadrage, mais également l’importance de développer l’approche anthropologique de la médecine légale, avec l’intégration de données populationnelles, sociales et culturelles.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Castro AL, Dias M, Reis F, et al. Gamma-hydroxybutyric acid endogenous production and post-mortem behaviour: The importance of different biological matrices, cut-off reference values, sample collection and storage conditions. J Forensic Leg Med 2014 ; 27 : 17–24. [CrossRef] [PubMed] [Google Scholar]
- Kietzerow J, Otto B, Wilke N, et al. The challenge of post-mortem GHB analysis: storage conditions and specimen types are both important. Int J Legal Med 2020 ; 134 : 205–15. [CrossRef] [PubMed] [Google Scholar]
- Busardò FP, Jones AW. Interpreting γ-hydroxybutyrate concentrations for clinical and forensic purposes. Clin Toxicol 2019 ; 57 : 149–63. [CrossRef] [PubMed] [Google Scholar]
- Busardò FP, Bertol E, Vaiano F, et al. Post mortem concentrations of endogenous gamma hydroxybutyric acid (GHB) and in vitro formation in stored blood and urine samples. Forensic Sci Int 2014 ; 243 : 144–8. [CrossRef] [PubMed] [Google Scholar]
- Charunyanont Y, Tubtimrattana A, Tansrisawad N, et al. Effect of body refrigeration on the postmortem formation of gamma hydroxybutyrate in whole blood. Forensic Sci Int 2022 ; 334 : 111247. [CrossRef] [PubMed] [Google Scholar]
- Thomsen R, Rasmussen BS, Johansen SS, et al. Postmortem concentrations of gamma-hydroxybutyrate (GHB) in peripheral blood and brain tissue: Differentiating between postmortem formation and antemortem intake. Forensic Sci Int 2017 ; 272 : 154–158. [CrossRef] [PubMed] [Google Scholar]
- Kintz P, Villain M, Cirimele V, et al. GHB in postmortem toxicology. Forensic Sci Int 2004 ; 143 : 177–81. [CrossRef] [PubMed] [Google Scholar]
- Nishimura H, Moriya F, Hashimoto Y. Mechanisms of γ-hydroxybutyric acid production during the early postmortem period. Forensic Toxicol 2009 ; 27 : 55–60. [CrossRef] [Google Scholar]
- Richard D, Ling B, Authier N, et al. GC/MS Profiling of γ-hydroxybutyrate and precursors in various animal tissues using automatic solid-phase extraction. Preliminary investigations of its potential interest in postmortem interval determination. anal Chem 2005 ; 77 : 1354–60. [CrossRef] [PubMed] [Google Scholar]
- Elliott SP. Gamma hydroxybutyric acid (GHB) concentrations in humans and factors affecting endogenous production. Forensic Sci Int 2003 ; 133 : 9–16. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Effets corporels et psychiques de la consommation de GHB. |
| Dans le texte | |
 |
Figure 2. Voies de synthèse du GHB. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




