| Numéro |
Med Sci (Paris)
Volume 40, Numéro 6-7, Juin-Juillet 2024
|
|
|---|---|---|
| Page(s) | 544 - 549 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2024082 | |
| Publié en ligne | 8 juillet 2024 | |
L’intestin, lanceur d’alerte, dans les prémices de la maladie de Parkinson
The gut, a whistleblower, in the early stages of Parkinson’s disease
1
Université Paris Cité, SPPIN ( Saint-Pères Paris Institute for the Neurosciences), CNRS UMR 8003, Paris, France
2
Nantes Université, Inserm U1235, TENSGBD ( The enteric nervous system in gut and brain disorders ), Nantes, France
3
CHU Nantes, Nantes Université, TENSGBD ( The enteric nervous system in gut and brain disorders ), Nantes, France
Le système nerveux entérique (SNE), souvent qualifié de « deuxième cerveau », joue un rôle crucial dans la régulation des fonctions digestives. Des dysfonctionnements du SNE sont associés à diverses maladies telles que la maladie de Parkinson. Des études récentes suggèrent que les troubles digestifs précoces, notamment la constipation chronique, pourraient être des signes avant-coureurs de cette maladie neurodégénérative. L’imagerie tridimensionnelle du SNE offre de nouvelles perspectives pour un diagnostic précoce via notamment l’analyse de biopsies intestinales. Ce nouvel axe de recherche soulève des questions sur l’origine intestinale de la maladie de Parkinson et ouvre la porte à une meilleure compréhension et une prise en charge anticipée de cette maladie.
Abstract
The enteric nervous system (ENS), often called the “second brain”, plays a crucial role in regulating digestive functions. Dysfunctions of the ENS are associated with several diseases such as Parkinson’s disease. Recent studies suggest that early digestive disorders, notably chronic constipation, may be early signs of this neurodegenerative disease. Three-dimensional imaging of the ENS offers new insights into early diagnosis, in particular through the analysis of intestinal biopsies. This new research axis raises questions about the intestinal cause of Parkinson’s disease, and opens the door to a better understanding and earlier treatment of this disease.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Clément Ricard).
Un deuxième cerveau dans le ventre ?
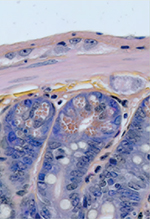
Le système nerveux entérique (SNE) est une composante autonome du système nerveux qui régule les fonctions digestives. Il est situé dans la paroi du tube digestif, du tiers inférieur de l’œsophage à l’anus [1, 2]. Le SNE est composé de plusieurs centaines de millions de cellules, aussi bien des neurones que des cellules gliales1, qui sont regroupées en ganglions nerveux reliés entre eux par des fibres inter-ganglionnaires, formant un réseau similaire aux mailles d’un filet tout le long et autour du tractus digestif. Ces ganglions sont répartis en deux principaux plexus localisés à deux niveaux de la paroi du tube digestif (Figure 1) :
 |
Figure 1. Histologie de la paroi intestinale et localisation des deux plexus du système nerveux entérique. |
-
Le plexus myentérique ou plexus d’Auerbach, qui se situe entre les couches musculaires circulaire et longitudinale, régule la contraction des muscles lisses pour garantir le péristaltisme et la segmentation2.
-
Le plexus sous-muqueux ou plexus de Meissner, qui est situé dans la sous-muqueuse, assure essentiellement le contrôle des fonctions de la barrière épithéliale intestinale.
Indispensable à l’homéostasie du tube digestif, le SNE est un régulateur majeur de la motricité et de la perméabilité intestinale. Des anomalies structurales, moléculaires ou des dysfonctions du SNE sont observées dans un contexte pathologique, aussi bien dans des maladies intestinales, telles que les maladies inflammatoires chroniques de l’intestin (MICI) [3], la maladie de Hirschsprung3 [4] mais – et peut être plus étonnant – également dans des maladies touchant le système nerveux central (SNC), comme la maladie de Parkinson [5].
Et la maladie de Parkinson ?
La maladie de Parkinson, deuxième maladie neurodégénérative la plus fréquente en France, après la maladie d’Alzheimer, compte environ 25 000 nouveaux cas diagnostiqués par an [6]. Même si les mécanismes moléculaires impliqués, le type de cellules affectées initialement, et la vulnérabilité d’une personne plutôt qu’une autre à la maladie restent controversés, la maladie de Parkinson est classiquement considérée comme une maladie du mouvement et du cerveau. En effet, la phase avancée de la maladie de Parkinson se caractérise par une augmentation du tonus musculaire, par des difficultés à effectuer les gestes alternatifs rapides, et par des tremblements. D’un point de vue neuropathologique, la maladie est caractérisée par une perte des neurones dopaminergiques de la substance noire4, responsable des signes moteurs, et par la présence d’inclusion intracellulaires (les corps et prolongements de Lewy [7]) dans les neurones persistants. L’alpha-synucléine, une protéine neuronale très abondante dans l’organisme et en particulier dans le cerveau, impliquée dans la libération des neurotransmetteurs et la régulation des niveaux de dopamine, est l’un des principaux composants des corps et prolongements de Lewy5, dans lesquels elle est agrégée et phosphorylée sur la sérine en position 129 de sa séquence protéique [8]. L’immunohistochimie ciblant l’alpha-synucléine et la phospho-sérine 129-alpha-synucléine est actuellement la méthode de référence pour détecter cette maladie à corps de Lewy. Cependant, lors de l’apparition des symptômes moteurs de la maladie de Parkinson, on peut considérer qu’environ 50 à 70 % des neurones dopaminergiques de la substance noire sont déjà détruits [9, 10]. Certains traitements palliatifs sont alors proposés, comme le traitement par Lévodopa (qui contient de la L-dopa qui se transforme en dopamine dans l’organisme) ou la stimulation cérébrale profonde, mais aucun traitement curatif n’existe aujourd’hui [11–13].
L’intestin, une sentinelle pour le diagnostic de la maladie de Parkinson
Bien que les troubles digestifs soient très courants chez les patients parkinsoniens, l’examen des antécédents médicaux de ces patients montre la présence de symptômes avant-coureurs qui surviennent très précocement, avant même le diagnostic de la maladie, tels que des troubles du sommeil, une fatigue intense, de l’anxiété ou encore des troubles digestifs comme la constipation [12, 14].
Au vu de ces constatations, ne peut-on pas s’interroger sur le potentiel de certains de ces symptômes comme marqueurs précoces de la survenue de la maladie de Parkinson ? Ces observations ne suggéreraient-elles pas qu’au lieu de prendre origine au niveau du SNC, la maladie de Parkinson pourrait débuter au sein du système nerveux entérique (SNE) ?
Il est désormais bien établi que la maladie de Parkinson n’est pas uniquement une maladie du mouvement et du SNC, mais aussi une maladie de la motricité du tube digestif et du SNE. Mais cela n’est, cependant, pas si évident. En effet, si les troubles de la motricité digestive, en particulier la constipation, sont particulièrement fréquents au cours de la maladie [15], et que des dépôts d’alpha-synucléine sont observés dans le SNE chez la grande majorité des personnes atteintes de la maladie de Parkinson [16], certains patients n’en présentent pas. De même, au cours des neuropathies entériques, les troubles de la motricité digestive s’accompagnent le plus souvent de modifications du SNE avec en particulier une perte neuronale, sans pour autant conduire à une maladie de Parkinson [17].
Bien que préliminaires, les données disponibles ne montrent pas de perte de neurones dans le tube digestif des sujets parkinsoniens par rapport à des sujets témoins, que ce soit dans le plexus sous-muqueux [18] ou dans le plexus myentérique [19]. Mais comment l’atteinte digestive au cours de la maladie de Parkinson peut-elle alors s’expliquer ? L’apparition des symptômes digestifs pourrait être révélatrice : on pourrait, en effet, envisager que les symptômes observés ex post (après les faits) chez les patients diagnostiqués ne sont pas des effets secondaires de la maladie, mais – dans certains cas – causales de celle-ci. Si la constipation fait partie des symptômes secondaires bien établis chez les patients parkinsoniens, son apparition à des stades antérieurs pourrait être un marqueur d’anomalies du SNE et constituer un élément de diagnostic plus précoce de la maladie.
L’hypothèse avancée par l’anatomiste Heiko Braak, professeur à l’université d’Ulm en Allemagne, postule que la maladie de Parkinson pourrait prendre son origine au niveau du SNE pour atteindre progressivement le cerveau, via une migration de la protéine alpha-synucléine à partir du SNE vers le SNC par l’intermédiaire du nerf vague [20, 21].
Il n’est également pas possible d’exclure que ces symptômes digestifs soient la conséquence de l’atteinte de l’innervation extrinsèque du tube digestif (noyau dorsal moteur du nerf vague et ses efférences) qui est aussi observée au cours de la maladie [22]. Il est en revanche peu probable que la seule présence de dépôts d’alpha-synucléine suffise à entraîner les signes digestifs puisque les signes moteurs « centraux » sont en lien avec la perte neuronale dopaminergique et non avec la maladie à corps de Lewy [23]. Cependant, envisager que des anomalies des neurones entériques restent indétectées de nos jours par les techniques d’immunohistochimie habituellement utilisées pour analyser le SNE est très plausible. En effet, l’analyse quantitative des ganglions du SNE est rendue difficile en raison de son organisation tridimensionnelle complexe. De plus, les techniques actuellement disponibles ne permettent qu’une analyse en deux dimensions, ce qui limite la capacité à appréhender pleinement la structure et la distribution des cellules dans cette région [17].
Nos données préliminaires, consistant à analyser le SNE différemment, suggèrent que des anomalies des neurones du SNE, induites par la protéine alpha-synucléine, peuvent être observées lorsque l’on examine des biopsies (obtenues par coloscopie) provenant de patients.
Si la neurodégénérescence dans l’intestin peut être une explication des troubles digestifs précoces présents chez les patients atteints de la maladie de Parkinson, et représenter un marqueur potentiel pour son diagnostic précoce, une question reste ouverte : pourquoi la maladie de Parkinson prend-elle son origine dans le tube digestif ? Y aurait-il des facteurs de risque, des aliments, des toxines, des parasites ou des agents pathogènes qui favoriseraient l’apparition des agrégats pathologiques d’alpha-synucléine dans les neurones de l’intestin, comme le suggère Heiko Braak ? Certaines études questionnent la pathogénicité de certains pesticides utilisés dans l’agriculture, comme le paraquat6, et sur leur rôle dans le développement de la maladie de Parkinson, notamment chez les agriculteurs [24].
Comprendre les altérations de la structure du SNE en 3 dimensions
L’intérêt grandissant des chercheurs dans la compréhension de l’implication de l’intestin (considéré comme notre « deuxième cerveau » [25]) dans la physiologie du corps humain, et son dialogue privilégié avec le SNC, a été à l’origine du développement de différentes techniques permettant de mieux analyser le SNE.
Traditionnellement, le SNE est étudié à partir de fines coupes (en général de 7 µm d’épaisseur) d’intestin avec des méthodes de coloration histologiques telles que la coloration par hématoxyline-éosine, et observées à l’aide d’un microscope classique à fond clair (Figure 2A). Bien que cette technique permette de visualiser les différents plexus, il est difficile d’appréhender une structure complexe discontinue et ganglionnaire en trois dimensions (3D) à partir de fines coupes en deux dimensions (2D). Trouver les deux types de plexus (voir plus haut) sur une même coupe est rare mais possible. Cependant, comprendre leur connectivité le long du tube digestif relève de l’impossible.
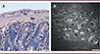 |
Figure 2. A. Coupe transversale fine d’un intestin de souris coloré à l’hématoxyline/éosine/safran et observée en microscopie à fond clair. B. Coupe optique longitudinale au niveau du plexus myentérique (d’Auerbach) obtenue par acquisition du signal d’autofluorescence sur un microscope biphotonique à disque rotatif unique. Au : plexus myentérique (d’Auerbach) ; Me : plexus sous-muqueux (de Meissner). Barre d’échelle : 20 µm. |
D’autres approches existent pour étudier le SNE, comme la technique du whole-mount. Il s’agit d’un processus fastidieux qui nécessite des compétences techniques élevées de microdissection afin d’isoler les différents plexus du SNE de la paroi intestinale [18]. Si cette technique permet de mieux étudier la connectivité entre les différents ganglions, l’isolement des ganglions conduit à une perte du contexte tissulaire et, de ce fait, conduit à une observation en 2D des ganglions.
Il est également possible d’étudier le SNE dans des modèles animaux, notamment des souris transgéniques, grâce à des protocoles chirurgicaux dédiés et à l’imagerie intra-vitale [26]. Cependant, cette approche peut être longue à mettre en place et nécessite un environnement adapté. Les compétences requises pour cette approche et le matériel dédié ne sont pas disponibles dans tous les laboratoires. Il reste enfin la question de la pertinence du modèle animal pour décrire de façon adéquate la maladie chez l’homme. Dans le cas des maladies neurodégénératives, qui, par définition, évoluent sur le long terme et se déclarent le plus souvent à un âge avancé, la durée de vie du modèle animal ne permet pas le développement « naturel » et l’observation de l’évolution de la maladie. De plus, les modèles animaux utilisés pour la compréhension de ces maladies évoluent dans des environnements fortement contrôlés (nourriture, cage de vie), assez éloignés de l’environnement et du mode de vie des êtres humains. Or, le développement de certaines maladies comme la maladie de Parkinson est multifactoriel. Enfin, les modèles animaux développés en laboratoire ne couvrent pas la maladie dans sa globalité, mais permettent, le plus souvent, uniquement l’étude de cas rares ou extrêmes. Par exemple, pour l’étude du lien entre le SNE et le développement de la maladie de Parkinson, des modèles murins reposant sur l’injection de fortes concentrations d’alpha-synucléine pathologique humaine dans le tractus digestif sont utilisés. Cependant, se pose la question de savoir si les observations obtenues avec ces modèles sont pertinentes par rapport à la situation physiopathologique chez l’homme.
Vers un diagnostic de la maladie de Parkinson à partir de coloscopies
Les limites des méthodes disponibles pour l’analyse du SNE nous ont conduits à développer une technique d’imagerie rapide permettant d’étudier la structure 3D du SNE humain avec une résolution sub-cellulaire [27]. Cette technique consiste à imager en profondeur et sans marquage préalable des échantillons épais d’intestin, en produisant un contraste grâce à la seule fluorescence naturelle des tissus. Cette autofluorescence, qui est présente dans tous les tissus biologiques, provient de certaines biomolécules endogènes, telles que le nicotinamide adénine dinucléotide (NADH), les flavines ou la lipofuscine [28]. Bien qu’elle soit fréquemment responsable d’un bruit de fond indésirable en microscopie, l’autofluorescence peut toutefois être utilisée comme un contraste endogène, ne nécessitant pas de coloration. Cependant, les signaux d’autofluorescence sont très faibles, et la nécessité d’imager dans un bloc de tissu intact ne facilite pas l’approche. Nous avons donc associé à l’imagerie biphotonique ultra-rapide une nouvelle méthode de transparisation chimique des tissus7, efficace en quelques minutes et non toxique (Figure 3). La combinaison d’une technique de microscopie avancée avec la transparisation des tissus permet de réaliser une imagerie des échantillons intestinaux épais, uniquement fondée sur les signaux d’autofluorescence (Figure 2B) [27].
 |
Figure 3. Transparisation rapide d’un échantillon d’intestin grêle de souris. Coupes longitudinales d’iléon observées à différents moments après ajout du réactif de transparisation (0 s, 10 s, 10 min, 20 min) sur un motif noir et blanc. |
La microscopie biphotonique utilise la lumière infrarouge, concentrée en des impulsions ultra-brèves afin de produire la fluorescence [29, 30]. L’utilisation de la lumière infrarouge – moins diffusée et absorbée que la lumière visible – résulte en une meilleure pénétration dans les tissus. L’effet non-linéaire (deux photons de lumière infrarouge sont nécessaires pour exciter l’autofluorescence) a comme résultat une localisation de l’excitation en un point, qui est ensuite balayé à travers le volume du tissu afin de reconstruire l’image. Le microscope biphotonique à disque rotatif unique, prototype développé par notre laboratoire, parallélise cette stratégie afin d’obtenir une excitation similaire à un feuillet de lumière, qui est ensuite imagé sur une caméra sensible afin d’obtenir une image volumétrique (Figure 4) [31].
 |
Figure 4. Schéma optique simplifié du microscope biphotonique à disque rotatif unique OASIS (On-axis 2-photon light-sheet generation in-vivo imaging system). |
L’analyse de biopsies de tube digestif après transparisation rapide et imagerie 3D nous a permis de réaliser l’analyse du tissu intestinal selon un flux (workflow) intégré, afin de visualiser sans marquage les mêmes structures qu’avec des protocoles classiques d’histologie, avec cependant un gain de temps d’un facteur 10 comparé à un microscope confocal classique qui, en outre, ne permet pas une imagerie aussi profonde. Notre protocole s’illustre surtout dans la possibilité de visualiser la paroi intestinale dans toute son épaisseur, de la séreuse aux cryptes. Il permet d’observer, de manière simple et rapide, les différents composants du SNE, tels que le plexus myentérique et ses corps cellulaires de neurones ou encore, dans la sous-muqueuse, les cellules du plexus sous-muqueux. Le SNE est ainsi observé en 3D facilement et rapidement, ce qui était jusqu’à présent impossible. Validée en recherche fondamentale [27], cette technique permet de mieux connaître et comprendre de façon intégrée le SNE.
Vers une anatomopathologie à très grande vitesse (AGV)
De manière usuelle, l’étude des tissus en anatomopathologie, quelle que soit la maladie, consiste en la réalisation d’un ensemble de coupes sur plusieurs lames. Mais, seules quelques-unes de ces lames sont généralement analysées. Par exemple, le diagnostic de la maladie de Parkinson est établi si l’une des lames analysées présente un marquage positif de l’alpha synucléine pathologique. Pourtant, l’analyse de quelques lames n’est que peu représentative de l’ensemble de l’échantillon.
Dans notre démarche de développement d’une méthode d’analyse du SNE pour un éventuel diagnostic plus précoce de la maladie de Parkinson, les résultats préliminaires montrent qu’étudier les échantillons dans leur ensemble présente une importance majeure.
Nous avons pu en effet constater des modifications structurelles des ganglions nerveux dans des tissus pathologiques issus de patients diagnostiqués parkinsoniens (données non publiées). Ces résultats encourageants nous laissent envisager la possibilité de diagnostiquer cette neuropathie beaucoup plus tôt, avant qu’elle ne cause ses dommages cérébraux et cognitifs. Ils permettent également d’envisager une prise en charge anticipée des patients. Enfin, d’un point de vue plus fondamental, ils permettent de mieux cerner les aspects physiopathologiques de la maladie de Parkinson et, notamment, l’implication de l’axe intestin-cerveau au cours de sa progression.
Liens d’intérêts
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les auteurs remercient la plateforme HistIM « Histologie, Immunomarquage, Microdissection laser » de l’Institut Cochin (Inserm U1016, CNRS UMR 8104, Université Paris Cité) pour l’aide apportée pour les colorations à l’hématoxyline-éosine.
Les auteurs remercient également Fabrice Licata (Plateforme d’imagerie) et le Dr. Andi Deeg (Till Photonics) pour leur soutien.
Références
- Avetisyan M, Schill EM, Heuckeroth RO. Building a second brain in the bowel. J Clin Invest 2015 ; 125 : 899–907. [CrossRef] [PubMed] [Google Scholar]
- Schneider S, Wright CM, Heuckeroth RO. Unexpected Roles for the Second Brain: Enteric Nervous System as Master Regulator of Bowel Function. Annu Rev Physiol 2019 ; 81 : 235–259. [CrossRef] [PubMed] [Google Scholar]
- Schneider KM, Blank N, Alvarez Y, et al. The enteric nervous system relays psychological stress to intestinal inflammation. Cell 2023; 186 : 2823–38.e20. [CrossRef] [PubMed] [Google Scholar]
- Mueller JL, Goldstein AM. The science of Hirschsprung disease: What we know and where we are headed. Semin Pediatr Surg 2022; 31 : 151157. [CrossRef] [PubMed] [Google Scholar]
- Guilhem de Lataillade A de, Lebouvier T, Noble W, et al. Enteric synucleinopathy: from trendy concept to real entity. Free Neuropathol 2020; 1 : 1–26. [PubMed] [Google Scholar]
- Simon DK, Tanner CM, Brundin P. Parkinson Disease Epidemiology, Pathology, Genetics, and Pathophysiology. Clin Geriatr Med 2020; 36 : 1–12. [CrossRef] [PubMed] [Google Scholar]
- Dickson DW. Neuropathology of Parkinson disease. Parkinsonism Relat Disord 2018 ; 46 Suppl 1: S30–S33. [CrossRef] [PubMed] [Google Scholar]
- Burré J, Sharma M, Südhof TC. Cell Biology and Pathophysiology of α-Synuclein. Cold Spring Harb Perspect Med 2018 ; 8 : a024091. [CrossRef] [PubMed] [Google Scholar]
- Lang AE, Lozano AM. Parkinson’s disease. First of two parts. N Engl J Med 1998 ; 339 : 1044–1053. [CrossRef] [PubMed] [Google Scholar]
- Ross GW, Petrovitch H, Abbott RD, et al. Parkinsonian signs and substantia nigra neuron density in decendents elders without PD. Ann Neurol 2004 ; 56 : 532–539. [CrossRef] [PubMed] [Google Scholar]
- Pollak P, Fraix V, Krack P, et al. Treatment results: Parkinson’s disease. Mov Disord 2002 ; 17 Suppl 3: S75–S83. [CrossRef] [PubMed] [Google Scholar]
- Armstrong MJ, Okun MS. Diagnosis and Treatment of Parkinson Disease: A Review. JAMA 2020; 323 : 548–60. [CrossRef] [PubMed] [Google Scholar]
- Fox SH, Katzenschlager R, Lim S-Y, et al. International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson’s disease. Mov Disord 2018 ; 33 : 1248–1266. [CrossRef] [PubMed] [Google Scholar]
- Stocchi F, Torti M. Constipation in Parkinson’s Disease. Int Rev Neurobiol 2017 ; 134 : 811–826. [CrossRef] [PubMed] [Google Scholar]
- Knudsen K, Fedorova TD, Bekker AC, et al. Objective Colonic Dysfunction is Far more Prevalent than Subjective Constipation in Parkinson’s Disease: A Colon Transit and Volume Study. J Parkinsons Dis 2017 ; 7 : 359–367. [CrossRef] [PubMed] [Google Scholar]
- Beach TG, Adler CH, Sue LI, et al. Multi-organ distribution of phosphorylated alpha-synuclein histopathology in subjects with Lewy body disorders. Acta Neuropathol 2010 ; 119 : 689–702. [CrossRef] [PubMed] [Google Scholar]
- De Giorgio R, Bianco F, Latorre R, et al. Enteric neuropathies: Yesterday, Today and Tomorrow. In: Brierley S, Costa M, editors. The Enteric Nervous System: 30 Years Later. Advances in Experimental Medicine and Biology. Cham : Springer International Publishing, 2016 : pp. 123–33. [CrossRef] [PubMed] [Google Scholar]
- Lebouvier T, Neunlist M, Bruley des Varannes S, et al. Colonic biopsies to assess the neuropathology of Parkinson’s disease and its relationship with symptoms. PLoS One 2010 ; 5 : e12728. [Google Scholar]
- Annerino DM, Arshad S, Taylor GM, et al. Parkinson’s disease is not associated with gastrointestinal myenteric ganglion neuron loss. Acta Neuropathol 2012 ; 124 : 665–680. [CrossRef] [PubMed] [Google Scholar]
- Braak H, de Vos RAI, Bohl J, et al. Gastric alpha-synuclein immunoreactive inclusions in Meissner’s and Auerbach’s plexuses in cases staged for Parkinson’s disease-related brain pathology. Neurosci Lett 2006 ; 396 : 67–72. [CrossRef] [PubMed] [Google Scholar]
- Rietdijk CD, Perez-Pardo P, Garssen J, et al. Exploring Braak’s Hypothesis of Parkinson’s Disease. Front Neurol 2017 ; 8 : 37. [CrossRef] [PubMed] [Google Scholar]
- Beach TG, Adler CH, Sue LI, et al. Vagus Nerve and Stomach Synucleinopathy in Parkinson’s Disease, Incidental Lewy Body Disease, and Normal Elderly Subjects: Evidence Against the “Body-First” Hypothesis. J Parkinsons Dis 2021; 11 : 1833–43. [CrossRef] [PubMed] [Google Scholar]
- Greffard S, Verny M, Bonnet A-M, et al. Motor score of the Unified Parkinson Disease Rating Scale as a good predictor of Lewy body-associated neuronal loss in the substantia nigra. Arch Neurol 2006 ; 63 : 584–588. [CrossRef] [PubMed] [Google Scholar]
- Kulcsarova K, Bang C, Berg D, et al. Pesticides and the Microbiome-Gut-Brain Axis: Convergent Pathways in the Pathogenesis of Parkinson’s Disease. J Parkinsons Dis 2023; 13 : 1079–106. [CrossRef] [PubMed] [Google Scholar]
- Gershon MD. The enteric nervous system: a second brain. Hosp Pract (1995) 1999; 34 : 31–2, 35–8, 41–2 passim. [CrossRef] [PubMed] [Google Scholar]
- Motegi Y, Sato M, Horiguchi K, et al. Confocal and multiphoton calcium imaging of the enteric nervous system in anesthetized mice. Neurosci Res 2020; 151 : 53–60. [CrossRef] [PubMed] [Google Scholar]
- Hazart D, Delhomme B, Oheim M, et al. Label-free, fast, 2-photon volume imaging of the organization of neurons and glia in the enteric nervous system. Front Neuroanat 2022; 16 : 1070062. [Google Scholar]
- Zipfel WR, Williams RM, Christie R, et al. Live tissue intrinsic emission microscopy using multiphoton-excited native fluorescence and second harmonic generation. Proc Natl Acad Sci U S A 2003 ; 100 : 7075–7080. [CrossRef] [PubMed] [Google Scholar]
- Denk W, Strickler JH, Webb WW. Two-photon laser scanning fluorescence microscopy. Science 1990 ; 248 : 73–76. [NASA ADS] [CrossRef] [Google Scholar]
- Helmchen F, Denk W. Deep tissue two-photon microscopy. Nat Methods 2005 ; 2 : 932–940. [CrossRef] [PubMed] [Google Scholar]
- Rakotoson I, Delhomme B, Djian P, et al. Fast 3-D Imaging of Brain Organoids With a New Single-Objective Planar-Illumination Two-Photon Microscope. Front Neuroanat 2019 ; 13 : 77. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Histologie de la paroi intestinale et localisation des deux plexus du système nerveux entérique. |
| Dans le texte | |
 |
Figure 2. A. Coupe transversale fine d’un intestin de souris coloré à l’hématoxyline/éosine/safran et observée en microscopie à fond clair. B. Coupe optique longitudinale au niveau du plexus myentérique (d’Auerbach) obtenue par acquisition du signal d’autofluorescence sur un microscope biphotonique à disque rotatif unique. Au : plexus myentérique (d’Auerbach) ; Me : plexus sous-muqueux (de Meissner). Barre d’échelle : 20 µm. |
| Dans le texte | |
 |
Figure 3. Transparisation rapide d’un échantillon d’intestin grêle de souris. Coupes longitudinales d’iléon observées à différents moments après ajout du réactif de transparisation (0 s, 10 s, 10 min, 20 min) sur un motif noir et blanc. |
| Dans le texte | |
 |
Figure 4. Schéma optique simplifié du microscope biphotonique à disque rotatif unique OASIS (On-axis 2-photon light-sheet generation in-vivo imaging system). |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




