| Numéro |
Med Sci (Paris)
Volume 35, Numéro 5, Mai 2019
|
|
|---|---|---|
| Page(s) | 417 - 419 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2019087 | |
| Publié en ligne | 22 mai 2019 | |
Vers la bioproduction de métabolites anticancéreux par les levures
Towards bioproduction of anticancer drugs by yeast
1
Université de Tours, EA2106 Biomolécules et biotechnologies végétales, 31, avenue Monge, 37200 Tours, France
2
Groupe d’étude des interactions hôte-pathogène, GEIHP, EA 3142, SFR ICAT 4208, Université d’Angers, Université de Brest, Institut de biologie en santé, IRIS, CHU d’Angers, 4, rue Larrey, 49100 Angers, France
Les cancers restent à ce jour une cause majeure de morbidité et de mortalité à travers le monde. À l’échelle du globe, on ne dénombre en effet pas moins de 8 millions de morts par an dus à des cancers [1]. En France, bien que des progrès spectaculaires soient régulièrement réalisés dans la prise en charge de ces pathologies, les chiffres demeurent accablants. C’est encore plus de 400 000 nouveaux cas qui sont diagnostiqués chaque année et ce sont 150 000 hommes et femmes qui décèdent de ces affections malignes. Chez l’homme, les nouveaux cas restent majoritairement représentés par le cancer de la prostate, le cancer du poumon, deuxième cancer le plus fréquent, suivi du cancer colorectal. Chez la femme, le cancer du sein est de loin le plus fréquent devant le cancer du côlon-rectum et le cancer du poumon [2].
Les traitements actuellement disponibles
Aujourd’hui, le schéma thérapeutique proposé dans le cadre de la prise en charge d’un cancer s’adapte à chaque situation. On peut citer parmi les stratégies curatives principales, la chirurgie, la radiothérapie et la chimiothérapie. Si, dans le traitement des cancers, les médicaments de thérapie ciblée (inhibiteurs de tyrosine kinase, anticorps monoclonaux, etc.) ont connu un très fort développement ces dernières années dans les pays développés, les cytotoxiques font toujours l’objet d’une forte demande au niveau mondial. Parmi les composés cytotoxiques anticancéreux les plus utilisés, on dénombre les agents alkylants (sels de platine), les intercalants (idarubicine), les scindants (bléomycine), les inhibiteurs de topoisomérases (irinotécan, topotécan, étoposide), les antimétabolites (raltitrexed, méthotrexate, cytarabine, etc.) et les molécules ciblant le fuseau mitotique (vinca-alcaloïdes, taxanes) [3].
Les anticancéreux d’origine végétale
Les anticancéreux ciblant le fuseau mitotique des cellules tumorales ont pour caractère commun d’être extraits de plantes médicinales. Ils sont majoritairement représentés par deux séries de molécules biologiques : les taxanes de l’if européen (Taxus baccata) et les vinca-alcaloïdes de la pervenche de Madagascar (Catharanthus roseus) [3, 4] (→).
(→) Voir la Synthèse de L. Faye et Y. Champey, m/s n° 11, novembre 2008, page 939
Les vinca-alcaloïdes anticancéreux (vinblastine, vincristine et dérivés semi-synthétiques) inhibent la polymérisation de la tubuline dans les cellules en division. Ils sont utilisés dans le traitement d’un grand nombre de cancers. La vinblastine demeure un antimitotique majeur de l’arsenal thérapeutique aujourd’hui disponible pour traiter par exemple les cancers de l’ovaire, de la vessie, du rein, du sein, du testicule, les choriocarcinomes, les histiocytoses, les lymphomes non hodgkiniens, les maladies de Hodgkin, ainsi que les sarcomes de Kaposi [5].
Le faible taux de biosynthèse de ces alcaloïdes in planta a conduit l’industrie pharmaceutique à produire ces molécules par condensation chimique de leurs deux précurseurs, la vindoline et la catharanthine, présents en quantité plus importante dans les feuilles de la plante. Celle-ci est donc cultivée à grande échelle et utilisée comme source de matière première. De fait, l’approvisionnement en vindoline et catharanthine reste fluctuant et dépendant de divers facteurs externes, dont les aléas climatiques et géopolitiques.
Vers des alternatives de bioproduction à haut rendement
L’intérêt thérapeutique des vinca-alcaloïdes anticancéreux, la faible abondance de leurs précurseurs dans la plante et leur coût de production sont à l’origine de nombreux travaux de recherche visant à améliorer les rendements de production de ces molécules. Le marché mondial pour la vincristine et la vinblastine se situe autour de 300 millions de dollars, avec une valeur marchande, bien que très variable selon les fournisseurs, de plusieurs milliers de dollars le gramme.
Depuis de nombreuses années, un certain nombre d’équipes de recherche à travers le monde ont donc porté leurs efforts sur l’identification des enzymes impliquées dans la voie de biosynthèse des vinca-alcaloïdes anticancéreux de la pervenche de Madagascar [6]. Une fois identifiés, les gènes codant ces enzymes végétales pourraient en effet être transférés dans des microorganismes (en particulier la levure Saccharomyces cerevisiæ) qui seraient alors capables de produire en grande quantité les précurseurs vindoline et catharanthine. De telles approches dites « d’ingénierie métabolique » ont déjà porté leurs fruits dans le domaine de la santé. L’incontournable artémisinine, molécule végétale antipaludique extraite initialement de l’armoise annuelle (Artemisia annua)1 [7] (→) a ainsi été le premier médicament produit par ingénierie métabolique et commercialisé en 2013. Cette molécule a en effet été biosynthétisée, par une levure modifiée, à l’échelle de plusieurs dizaines de tonnes par an [8].
(→) Voir Repères de D. Mazet et M. Thellier, m/s n° 1, janvier 2016, page 106
Identification des dernières étapes inconnues menant à la vindoline et la catharanthine
Les vinca-alcaloïdes anticancéreux et leurs précurseurs, vindoline et catharanthine, appartiennent à la famille des alcaloïdes indoliques monoterpéniques (AIM) [9]. La voie de biosynthèse des AIM dans la plante est très complexe. Elle fait intervenir plus d’une trentaine d’étapes enzymatiques [10]. Si les enzymes impliquées au début et au milieu de la voie de synthèse ont été progressivement identifiées et caractérisées au cours des dernières décennies, les derniers chaînons en fin de voie restaient encore à élucider. En collaboration avec le groupe de recherche du Dr Sarah O’Connor du John Innes Centre (au Royaume-Uni), notre équipe a participé à une avancée majeure touchant le secteur des biotechnologies appliquées à la santé humaine et qui a été récemment publiée dans la revue Science [11]. Nous avons en effet identifié et caractérisé les dernières enzymes clés qui manquaient jusqu’alors pour compléter la voie de biosynthèse conduisant aux précurseurs vindoline et catharanthine (Figure 1). Nous avons pu montrer l’implication de deux enzymes, une oxydase et une réductase, qui transforment l’acétate de stemmadénine en acétate de dihydroprécondylocarpine. Ce dernier est ensuite modifié et cyclisé par deux hydrolases pour aboutir soit à la catharanthine, soit à la tabersonine (les étapes menant de la tabersonine à la vindoline avaient été préalablement caractérisées). Plus précisément, l’acétate de stemmadénine est séquentiellement converti en catharanthine par les enzymes précondylocarpine acétate synthase (PAS), dihydroprécondylocarpine synthase (DPAS) et catharanthine synthase (CS). Parallèlement, l’acétate de stemmadénine peut être converti en tabersonine grâce à l’action des enzymes précondylocarpine acétate synthase (PAS), dihydroprécondylocarpine synthase (DPAS) et tabersonine synthase (TS) (Figure 1).
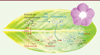 |
Figure 1. Caractérisation des enzymes de la voie de biosynthèse menant à la catharanthine et à la tabersonine. L’acétate de stemmadénine est converti en catharanthine par les enzymes précondylocarpine acétate synthase (PAS), dihydroprécondylocarpine synthase (DPAS) et catharanthine synthase (CS). Parallèlement, l’acétate de stemmadénine peut être également converti en tabersonine grâce à l’action des enzymes précondylocarpine acétate synthase (PAS), dihydroprécondylocarpine synthase (DPAS) et tabersonine synthase (TS). Les étapes menant de la tabersonine à la vindoline ont été caractérisées dans de précédentes études. |
Demain, des levures de bière produiront les précurseurs des vinca-alcaloïdes anticancéreux…
Notre équipe est à l’origine de la découverte de bon nombre d’enzymes impliquées dans la biosynthèse des AIM [12]. Il est donc envisageable dès à présent de développer à court terme des levures capables de bioproduire par ingénierie métabolique et « à grande échelle » les précurseurs vindoline et catharanthine qui pourront être utilisés pour l’hémisynthèse des vinca-alcaloïdes anticancéreux.
Au-delà de ces résultats prometteurs et en s’inscrivant dans la transition chimie-bioproduction opérée dans l’industrie pharmaceutique, il sera possible, dans un futur proche, de transposer cette approche à la bioproduction de diverses familles chimiques d’anticancéreux, mais également à d’autres molécules d’intérêts pharmaceutiques.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Sa découverte et son utilisation ont été soulignées par le Prix Nobel de médecine ou physiologie de 2015 [7].
Références
- Global burden of disease cancer collaboration Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: a systematic analysis for the global burden of disease study. JAMA Oncol. 2017 ; 3 : 524–548. [CrossRef] [PubMed] [Google Scholar]
- Institut National du Cancer. Projection de l’incidence et de la mortalité en France métropolitaine en 2017. Rapport technique. Paris : INCa, janvier 2018. [Google Scholar]
- Faure S. Anticancéreux cytotoxiques. Actualités Pharmaceutiques. 2010 ; 49 : 51–54. [Google Scholar]
- Faye L, Champey Y. Plantes, médicaments et génétique - Quelles applications pour demain ?. Med Sci (Paris). 2008 ; 24 : 939–946. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Vidal 2001. Le dictionnaire. 77e ed. Paris : Éditions Vidal, 2001; 2343 : 256 p. [Google Scholar]
- Courdavault V, Papon N, Clastre M, et al. A look inside an alkaloid multisite plant: the Catharanthus logistics. Curr Opin Plant Biol. 2014 ; 19 : 43–50. [CrossRef] [PubMed] [Google Scholar]
- Mazier D, Thellier M. Youyou Tu, de Mao Zedong au Prix Nobel. Prix Nobel de Médecine 2015: William C. Campbell, Satoshi Ŏmura et Youyou Tu. Med Sci (Paris). 2016 ; 32 : 106–109. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature. 2013 ; 496 : 528–532. [CrossRef] [PubMed] [Google Scholar]
- St-Pierre B., Besseau S., Clastre M., et al. Deciphering the evolution, cell biology and regulation of monoterpene indole alkaloids. Adv Bot Res. 2013 ; 68 : 73–109. [Google Scholar]
- Dugé de Bernonville T, Clastre M, Besseau S, et al. Phytochemical genomics of the Madagascar periwinkle: unravelling the last twists of the alkaloid engine. Phytochemistry. 2015 ; 113 : 9–23. [CrossRef] [PubMed] [Google Scholar]
- Caputi L, Franke J, Farrow SC, et al. Missing enzymes in the biosynthesis of the anticancer drug vinblastine in Madagascar periwinkle. Science. 2018 ; 360 : 1235–1239. [Google Scholar]
- Carqueijeiro I, Brown S, Chung K, et al. Two tabersonine 6,7-epoxidases initiate lochnericine-derived alkaloid biosynthesis in Catharanthus roseus. Plant Physiol. 2018 ; 177 : 1473–1486. [Google Scholar]
© 2019 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Caractérisation des enzymes de la voie de biosynthèse menant à la catharanthine et à la tabersonine. L’acétate de stemmadénine est converti en catharanthine par les enzymes précondylocarpine acétate synthase (PAS), dihydroprécondylocarpine synthase (DPAS) et catharanthine synthase (CS). Parallèlement, l’acétate de stemmadénine peut être également converti en tabersonine grâce à l’action des enzymes précondylocarpine acétate synthase (PAS), dihydroprécondylocarpine synthase (DPAS) et tabersonine synthase (TS). Les étapes menant de la tabersonine à la vindoline ont été caractérisées dans de précédentes études. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




