| Issue |
Med Sci (Paris)
Volume 33, Number 5, Mai 2017
|
|
|---|---|---|
| Page(s) | 488 - 490 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20173305010 | |
| Published online | 14 June 2017 | |
Quand les cellules iNKT partent au charbon : nouvelles pistes thérapeutiques
iNKT cells: potential therapeutic targets to fight anthrax
1
Pathogénie des toxi-infections bactériennes, Institut Pasteur, 28, rue du Docteur Roux, 75724 Paris, France
2
Blish lab, department of medicine, Stanford immunology, Stanford university, Stanford, CA, États-Unis
3
Centre d’infection et d’immunité de Lille, Inserm U1019, CNRS UMR 8204, université de Lille, CHU Lille et Institut Pasteur de Lille, 1, rue du professeur Calmette, 59000 Lille, France
4
Unité interactions hôte-agents pathogènes, institut de recherche biomédicale des armées, BP73, 91223 Brétigny-sur-Orge, France
Les cellules tueuses naturelles (NK, natural killer) exprimant un récepteur des cellules T (TCR) semi-invariant sont nommées cellules iNKT (pour invariant natural killer T). Ce sont des cellules de l’immunité adaptative reconnaissant des antigènes lipidiques bactériens conservés et exprimant des marqueurs spécifiques des cellules tueuses naturelles [1, 2]. Les cellules présentatrices d’antigènes sont capables de phagocyter puis de détruire les bactéries exprimant des antigènes lipidiques pour les présenter aux cellules iNKT par l’intermédiaire de la molécule CD1d, une molécule apparentée au complexe majeur d’histocompatibilité de type I jouant le rôle de molécule présentatrice d’antigènes [3, 4]. En réponse à cette reconnaissance antigénique, les cellules iNKT produisent rapidement des cytokines et chimiokines permettant le recrutement et l’activation de cellules de l’immunité innée et adaptative [2, 5]. Les cellules iNKT peuvent notamment jouer un rôle important dans l’orchestration de la production d’anticorps par les lymphocytes B afin de détruire les bactéries infectieuses.
Plusieurs études ont montré le rôle potentiel de l’alpha-galactosylcéramide (α-GalCer), un glycolipide de synthèse, puissant agoniste du récepteur T des cellules iNKT, dans i) l’activation de ces cellules iNKT, ii) la mise en place du contrôle de certaines infections comme les pneumonies à Streptococcus pneumoniae [5], ou iii) pour promouvoir le développement de réponses anti-tumorales et anti-diabétiques [6] (→). Les cellules iNKT ont également été décrites comme jouant un rôle dans l’orchestration de l’immunité adaptative et la production d’anticorps par les lymphocytes B contre la bactérie Bacillus anthracis, l’agent de la maladie du charbon (ou anthrax pour les anglo-saxons) [7, 8]. Cependant, aucune étude ne s’est intéressée au rôle potentiel de l’activation des cellules iNKT par l’α-GalCer sur la réponse cellulaire à la suite d’une infection par B. anthracis.
(→) Voir la Synthèse de L. Gazharian et al., m/s n° 8-9, août-septembre 2013, page 722
Nous avons étudié l’effet de l’injection de l’α-GalCer sur la réponse immunitaire mettant en jeu les cellules iNKT [9]. En utilisant un modèle murin d’anthrax cutané au niveau de l’oreille, nous avons tout d’abord démontré que l’injection simultanée de l’α-GalCer et de B. anthracis bloquait la dissémination de la bactérie dans le ganglion lymphatique (GL) drainant l’oreille infectée. Les souris infectées et n’ayant pas reçu l’α-GalCer présentaient une dissémination systémique de la bactérie détectable dans la rate dès 24 h après l’infection. Par ailleurs, le traitement par l’α-GalCer des souris infectées permettait de contenir la dissémination bactérienne jusqu’à 46 h post-infection. Ce contrôle de la dissémination bactérienne s’accompagnait de plus d’une survie accrue des animaux traités par l’α-GalCer (survie moyenne de 48,5 h) comparée aux souris contrôles (survie moyenne de 33,4 h).
Le blocage de la dissémination de la bactérie au niveau du ganglion semble être en partie causé par la présence des macrophages sous-capsulaires CD169+, localisés au niveau de la capsule des GL. Suite à la déplétion de ces macrophages, nous observons en effet que, en présence d’α-GalCer, la bactérie n’est plus retenue au niveau des GL et l’activation des cellules iNKT est diminuée. La production d’interféron gamma (IFN-γ) et l’expression de CD69 par les cellules iNKT sont également fortement diminuées comparativement aux taux mesurés chez les souris possédant des macrophages CD169+.
La production de cytokines par les cellules iNKT est leur atout majeur pour activer les cellules de l’immunité innée et adaptative dans le but de contrôler les infections bactériennes et virales [1, 2]. Nous nous sommes donc intéressés aux cytokines connues pour être produites par les cellules iNKT comme l’IFN-γ, l’IL(interleukine)-4 et l’IL-17, ainsi qu’à une autre cytokine, l’IL-12, produite par les cellules dendritiques et capable d’activer les cellules iNKT. Nous avons injecté des anticorps bloquant spécifiquement l’activité de ces cytokines à des souris sauvages, 24 h avant l’injection de B. anthracis combinée ou non avec l’α-GalCer. Après infection, nous avons observé la dissémination de B. anthracis chez ces souris. Les anticorps bloquant l’activité de l’IL-4, l’IL-17 et l’IL-12 n’ont pas modifié la diffusion de la bactérie au niveau du GL et aucune bactérie n’a été trouvée au niveau de la rate. En revanche, l’injection de l’anticorps bloquant l’activité de l’IFN-γ a complétement annulé l’effet protecteur de l’α-GalCer sur la dissémination bactérienne, abrogeant également l’extension de la survie de ces souris. La production d’IFN-γ, probablement par les cellules iNKT, est donc impliquée dans le contrôle de la dissémination des bactéries suite à l’injection d’α-GalCer et l’allongement de la survie qui en résulte.
Nous nous sommes ensuite demandé si ce phénomène induit par l’α-GalCer pouvait résulter du recrutement de cellules immunitaires effectrices. Nous avons donc recherché la présence de certaines cellules immunitaires au sein du GL après infection des souris par B. anthracis avec ou sans α-GalCer. La présence de l’α-GalCer augmente de façon très significative le recrutement de polynucléaires neutrophiles au sein du GL. La déplétion de ces neutrophiles par l’injection d’un anticorps anti-Gr1 (granulocyte receptor 1) inhibe l’effet protecteur de l’α-GalCer, suggérant que le recrutement important de neutrophiles en réponse à l’α-GalCer est crucial pour la rétention des bactéries dans le GL et l’extension de la survie des souris.
Le recrutement des neutrophiles est généralement induit par la production de chimiokines telles que KC (pour kératynocyte chémoattractant, équivalent murin de l’IL8 chez l’homme) et les chimiokines ligands 2 ou 3 (CCL2 ou CCL3). Nous avons donc mesuré l’expression de ces chimiokines au sein du GL. Après infection, l’expression de KC et de CCL2 n’est pas significativement augmentée en présence d’α-GalCer. à l’inverse, l’expression de CCL3 est fortement stimulée par la présence d’α-GalCer. L’injection d’anticorps bloquant l’activité de CCL3 avant l’infection par B. anthracis a permis de démontrer que CCL3 est impliqué dans le recrutement des neutrophiles au sein du GL, stimulé par l’α-GalCer. La production de CCL3 est induite par le sécrétion d’IFN-g. Cependant, la source cellulaire de CCL3 n’a pas pu être déterminée. De plus, le blocage de l’activité de CCL3 abolit complètement l’effet protecteur de l’α-GalCer sur la survie des souris. Il semble donc que CCL3 soit impliqué dans le recrutement des neutrophiles provoqué par l’injection d’α-GalCer et, par conséquent, permette l’extension de la survie des souris infectées par B. anthracis.
Notre étude a permis de montrer pour la première fois que l’activation exogène des cellules iNKT par l’injection d’α-GalCer limite l’infection par l’agent de la maladie du charbon, de façon temporaire [9]. La production d’IFN-γ, probablement par les cellules iNKT, induite par la présence des macrophages CD169+ sous-capsulaires, est primordiale pour la rétention des bactéries dans les ganglions lymphatiques, en présence d’α-GalCer. L’activation des cellules iNKT est également cruciale pour la production de chimiokine CCL3 et le recrutement de neutrophiles, car elle bloque la dissémination des bactéries et augmente la survie des souris infectées induite par l’injection d’α-GalCer.
Cette étude démontre un nouveau mécanisme de régulation immunitaire au sein du GL. L’activation exogène des cellules iNKT par l’α-GalCer engendre une cascade d’activation immunitaire impliquant un axe macrophages CD169+/cellules iNKT/IFN-γ/CCL3/neutrophiles qui permet le contrôle partiel d’une infection bactérienne aussi virulente que celle de la maladie du charbon (Figure 1). La protection apportée par l’injection de produits exogènes tels que l’α-GalCer ouvre ainsi de nouvelles perspectives immuno-thérapeutiques dans le traitement des infections bactériennes fondées sur les propriétés immunomodulatrices des cellules iNKT.
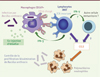 |
Figure 1. Mécanismes d’activation des cellules iNKT par l’ α-GalCer au niveau du ganglion lymphatique : blocage temporaire de la dissémination systémique de Bacillus anthracis. À la suite de l’injection sous-cutanée simultanée de Bacillus anthracis et de l’alpha-galactosylcéramide (α-GalCer), ce dernier atteint le ganglion lymphatique drainant le site de l’injection, puis est capté par les macrophages CD169+ sous-capsulaires. L’α-GalCer est ensuite présenté par les macrophages CD169+ sous-capsulaires au niveau du récepteur CD1d. Les cellules iNKT (invariant natural killer T) sont capables de reconnaître le couple CD1d/ α-GalCer, par le biais de leur TCR (T cell receptor) semi-invariant. Cette reconnaissance conduit à l’activation des cellules iNKT qui vont produire de l’interféron γ (IFN-γ). L’IFN-γ est primordial pour permettre la production de la chimiokine CCL3, qui va jouer un rôle de recruteur des polynucléaires neutrophiles, spécialisés dans la capture et l’élimination de pathogènes. Le recrutement des polynucléaires neutrophiles au niveau des ganglions lymphatiques (GL) permet de contenir les bactéries à ce niveau et empêche leur dissémination systémique. Ce mécanisme d’activation des cellules iNKT par l’injection d’ α-GalCer protège les animaux infectés par Bacillus anthracis de façon temporaire et permet d’envisager de nouveaux traitements thérapeutiques dans le cas d’infection cutanée bactérienne. |
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Bendelac A, Savage PB, Teyton L The biology of NKT cells. Annu Rev Immunol 2007 ; 25 : 297–336. [CrossRef] [PubMed] [Google Scholar]
- Brennan PJ, Brigl M, Brenner MB Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nat Rev Immunol 2013 ; 13 : 101–117. [CrossRef] [PubMed] [Google Scholar]
- Kronenberg M, Kinjo Y Innate-like recognition of microbes by invariant natural killer T cells. Curr Opin Immunol 2009 ; 21 : 391–396. [PubMed] [Google Scholar]
- Rossjohn J, Pellicci DG, Patel O, et al. Recognition of CD1d-restricted antigens by natural killer T cells. Nat Rev Immunol 2012 ; 12 : 845–857. [CrossRef] [PubMed] [Google Scholar]
- Ivanov S, Fontaine J, Paget C, et al. Key role for respiratory CD103(+) dendritic cells, IFN-gamma, and IL-17 in protection against Streptococcus pneumoniae infection in response to alpha-galactosylceramide. J Infect Dis 2012 ; 206 : 723–734. [CrossRef] [PubMed] [Google Scholar]
- Ghazarian L, Simoni Y, Pingris K, et al. Rôle régulateur des lymphocytes NKT dans la prévention du diabète de type 1. Med Sci (Paris) 2013 ; 29 : 722–728. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Joshi SK, Lang GA, Larabee JL, et al. Bacillus anthracis lethal toxin disrupts TCR signaling in CD1d-restricted NKT cells leading to functional anergy. PLoS Pathog 2009 ; 5 : e1000588. [PubMed] [Google Scholar]
- Devera TS, Aye LM, Lang GA, et al. CD1d-dependent B-cell help by NK-like T cells leads to enhanced and sustained production of Bacillus anthracis lethal toxin-neutralizing antibodies. Infect Immun 2010 ; 78 : 1610–1617. [CrossRef] [PubMed] [Google Scholar]
- Le Gars M, Haustant M, Klezovich-Bénard M, et al. Mechanisms of invariant NKT cell activity in restraining Bacillus anthracis systemic dissemination. J Immunol 2016 ; 197 : 3225–3232. [PubMed] [Google Scholar]
© 2017 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Mécanismes d’activation des cellules iNKT par l’ α-GalCer au niveau du ganglion lymphatique : blocage temporaire de la dissémination systémique de Bacillus anthracis. À la suite de l’injection sous-cutanée simultanée de Bacillus anthracis et de l’alpha-galactosylcéramide (α-GalCer), ce dernier atteint le ganglion lymphatique drainant le site de l’injection, puis est capté par les macrophages CD169+ sous-capsulaires. L’α-GalCer est ensuite présenté par les macrophages CD169+ sous-capsulaires au niveau du récepteur CD1d. Les cellules iNKT (invariant natural killer T) sont capables de reconnaître le couple CD1d/ α-GalCer, par le biais de leur TCR (T cell receptor) semi-invariant. Cette reconnaissance conduit à l’activation des cellules iNKT qui vont produire de l’interféron γ (IFN-γ). L’IFN-γ est primordial pour permettre la production de la chimiokine CCL3, qui va jouer un rôle de recruteur des polynucléaires neutrophiles, spécialisés dans la capture et l’élimination de pathogènes. Le recrutement des polynucléaires neutrophiles au niveau des ganglions lymphatiques (GL) permet de contenir les bactéries à ce niveau et empêche leur dissémination systémique. Ce mécanisme d’activation des cellules iNKT par l’injection d’ α-GalCer protège les animaux infectés par Bacillus anthracis de façon temporaire et permet d’envisager de nouveaux traitements thérapeutiques dans le cas d’infection cutanée bactérienne. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




