| Numéro |
Med Sci (Paris)
Volume 31, Numéro 8-9, Août–Septembre 2015
|
|
|---|---|---|
| Page(s) | 725 - 727 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20153108008 | |
| Publié en ligne | 4 septembre 2015 | |
Origine et développement des cellules dendritiques humaines
Origin and development of human dendritic cells
Laboratory of cellular physiology and immunology, the Rockefeller University, 1230 York avenue, 10065
New York, Etats-Unis
Les cellules dendritiques ont été découvertes en 1973 par Ralph Steinman et Zanvil Cohn alors que ces derniers cherchaient à comprendre comment une réponse immunitaire était induite dans les rates de souris [11]. Ils savaient que pour qu’une réponse immunitaire se développe, il fallait des lymphocytes mais aussi une cellule « accessoire » présentatrice d’antigènes. À cette époque, les immunologistes pensaient que cette cellule accessoire était un macrophage, et ce jusqu’à ce que R. Steinman et Z. Cohn découvrent une population de cellules rares, jamais observées auparavant, et à la forme inhabituelle ; parce que cette cellule était constellée de longs prolongements arborescents, R. Steinman et Z. Cohn l’ont appelée cellule dendritique (du grec dendreon qui signifie arbre). R. Steinman et Z. Cohn ont eu l’intuition que cette cellule était la cellule accessoire qu’ils recherchaient [1, 2]. Néanmoins, il leur a fallu beaucoup d’efforts et de persévérance pour démontrer que les cellules dendritiques n’étaient pas des macrophages mais bel et bien un type cellulaire différent, et en convaincre leurs collègues immunologistes [3]. Ce n’est que trois décennies plus tard que l’origine des cellules dendritiques chez la souris a été élucidée, et que le point de divergence entre les cellules dendritiques et les monocytes/macrophages a été défini [4].
Les différentes sous-populations de cellules dendritiques humaines
Les cellules dendritiques humaines ont été principalement étudiées dans le sang périphérique, et ont été classées en sous-populations en se fondant sur leur fonction et l’expression de marqueurs de surface. Les cellules dendritiques plasmacytoïdes expriment CD303 (BDCA-2, blood dendritic cell antigen 2) et ont l’unique capacité de produire de larges quantités d’interférons de type I en réponse à une infection virale [5]. Les cellules dendritiques myéloïdes - dites conventionnelles - qui expriment CD1c (BDCA-1) - présenteraient préférentiellement les antigènes aux cellules T CD4+ et seraient l’équivalent des cellules dendritiques CD11b+ chez la souris [6, 7]. Enfin, les cellules dendritiques conventionnelles qui expriment CD141 (BDCA-3) sont équivalentes aux cellules dendritiques CD8α+ murines ; elles ont la capacité de capturer les cellules nécrotiques ou apoptotiques via la lectine Clec9A et donc de cross-présenter les antigènes extracellulaires aux cellules T CD8+ lors des réponses antivirales ou anticancéreuses [6, 8](Figure 1).
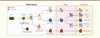 |
Figure 1. Développement des cellules dendritiques humaines. Le developpement des cellules dendritiques commence dans la moelle osseuse. Le progeniteur GMDP (granulocyte, monocyte and dendritic cell progenitor) se developpe en granulocytes et en un progeniteur commun aux cellules dendritiques et aux monocytes appele MDP (monocyte and dendritic cell progenitor). Le progeniteur MDP produit les monocytes ainsi qu’un progeniteur commun aux cellules dendritiques appele CDP (common DC progenitor). Le progeniteur CDP produit les cellules dendritiques plasmacytoides (pDC) ainsi qu’un precurseur immediat des cellules dendritiques conventionnelles appele pre-cDC (conventional dendritic cell precursor). Le precurseur pre-cDC est capable de migrer de la moelle osseuse vers les organes lymphoides secondaires via la circulation sanguine pour produire les deux sous-populations majeures de cellules dendritiques conventionnelles i.e. BDCA-1+ cDC et BDCA-3+ cDC. Le developpement des cellules dendritiques se fait sous le controle du recepteur du ligand de Flt3. Le developpement des monocytes se fait sous le controle du recepteur du M-CSF et est finalise dans la moelle osseuse ou un precurseur immediat des monocytes appele pre-mono (monocyte precursor) produit les monocytes. HSC : hematopoietic stem cells. |
Un système de culture avec stroma qui permet la différenciation in vitro des cellules dendritiques humaines
L’étude du développement des cellules dendritiques humaines a, jusqu’à présent, souffert de l’absence d’un système de culture qui permette le développement de potentiels progéniteurs en cellules dendritiques. Notre équipe a développé un système de culture efficace pour tester la capacité de progéniteurs à proliférer et à se différencier en présence de facteurs de croissance hématopoïétiques [9]. En testant de façon systématique différentes combinaisons d’hématopoïétines et de lignées stromales murines, nous avons montré que la culture in vitro de cellules souches et progéniteurs hématopoïétiques CD34+ issus de sang de cordon, en présence de cellules stromales MS-5 et de cytokines comme le ligand de Flt3 (Flt3l, FMS-like tyrosine kinase 3 ligand), le SCF (stem cell factor) et le GM-CSF (granulocyte-macrophage colony-stimulating factor), promeut la différenciation de cellules de type lymphoïde et myéloïde, y compris les trois sous-populations de cellules dendritiques. Les cellules dendritiques obtenues en culture ressemblent à celles du sang, que ce soit en ce qui concerne leur fonction ou leur transcriptome [9]. Nous disposons donc maintenant d’un système expérimental pour interroger le potentiel de différenciation de diverses cellules et permettre ainsi d’identifier les progéniteurs des cellules dendritiques humaines.
Identification de progéniteurs hématopoïétiques de cellules dendritiques dans la moelle osseuse
L’hématopoïèse étant en grande partie sous le contrôle de signaux provenant de niches hématopoïétiques situées au sein de la moelle osseuse, nous avons émis l’hypothèse selon laquelle le potentiel de différenciation d’un progéniteur est défini par la combinaison de récepteurs aux hématopoïétines qu’il exprime. En combinant le marqueur CD34 aux récepteurs d’hématopoïétines tels que CD135 (Flt3l-R), CD115 (M-CSF-R), CD117 (SCF-R), CD116 (GM-CSF-R) et CD123 (IL[interleukine]-3-R), notre groupe a récemment identifié quatre progéniteurs de cellules dendritiques dans la moelle osseuse [9, 10]. Nous avons montré, in vitro comme in vivo dans des expériences de transfert adoptif dans des souris humanisées, que les cellules dendritiques se développent à partir de progéniteurs bien définis et dont le potentiel se restreint progressivement. Les cellules dendritiques, les monocytes et les granulocytes sont issus d’un progéniteur commun appelé GMDP (granulocyte, monocyte and dendritic cell progenitor) [9]. Ce progéniteur GMDP se développe en un progéniteur commun uniquement aux cellules dendritiques et aux monocytes, appelé MDP (monocyte and dendritic cell progenitor) [9]. Ce progéniteur MDP se différencie en monocytes et en un progéniteur de cellules dendritiques appelé CDP (common dendritic cell progenitor) [9], qui a perdu la capacité de produire les monocytes, et qui donne naissance uniquement aux trois sous-populations de cellules dendritiques. Nous avons également identifié un précurseur immédiat des monocytes appelé pré-monocyte (monocyte precursor), qui dérive du progéniteur MDP et qui se trouve uniquement dans la moelle osseuse [9], ce qui signifie que le développement des monocytes est finalisé dans la moelle osseuse. Au cours de la différenciation de ces progéniteurs, le développement vers la lignée monocytaire se fait sous le contrôle du récepteur du M-CSF (monocyte colony stimulating factor), alors que le développement vers la lignée de cellules dendritiques se fait sous le contrôle du récepteur du ligand de Flt3.
Un précurseur immédiat des cellules dendritiques conventionnelles en périphérie
Les trois progéniteurs GMDP, MDP et CDP se trouvent uniquement dans la moelle osseuse et sont absents du sang et des tissus périphériques. Nous avons cependant identifié un précurseur immédiat des cellules dendritiques conventionnelles BDCA-1+ et BDCA-3+ appelé pré-cDC (conventional dendritic cell precursor) [10]. Ce précurseur pré-cDC a été identifié dans la moelle osseuse mais aussi dans le sang et dans les amygdales, ce qui signifie qu’il est capable de migrer de la moelle osseuse vers les organes lymphoïdes secondaires via la circulation sanguine. Ce précurseur pré-cDC provient de la différenciation des CDP dans la moelle osseuse. Il reste encore à déterminer si le précurseur pré-cDC se différencie en cellules dendritiques conventionnelles dans le sang et/ou en périphérie. Finalement, nous avons montré que le nombre de ces précurseurs pré-cDC, comme celui des trois populations plus différenciées de cellules dendritiques, augmente dans le sang de volontaires ayant reçu du ligand de Flt3.
Conclusion et perspective
Définir les progéniteurs et le précurseur immédiat des cellules dendritiques humaines constitue une étape importante dans la compréhension de ce lignage cellulaire et va servir de référence pour étudier leur développement, que ce soit dans un contexte normal, pathologique ou post-vaccinal. Il sera désormais possible de déterminer les gènes régulateurs qui contrôlent les différentes étapes du développement des cellules dendritiques. L’étude de pathologies associées à un développement anormal des cellules dendritiques, comme la leucémie myéloïde chronique ou certains déficits immunitaires caractérisés par l’absence de cellules dendritiques, sera facilitée. Connaître le développement des cellules dendritiques va aussi permettre l’établissement de nouvelles stratégies vaccinales basées sur ces cellules centrales de la réponse immunitaire. Enfin, l’exploitation des progéniteurs de cellules dendritiques dans des stratégies d’immunothérapie cellulaire pourra être testée.
Liens d’intérêt
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantification, tissue distribution. J Exp Med 1973 ; 137 : 1142–1162. [CrossRef] [PubMed] [Google Scholar]
- Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. II. Functional properties in vitro. J Exp Med 1974 ; 139 : 380–397. [CrossRef] [PubMed] [Google Scholar]
- Steinman RM, Witmer MD. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proc Natl Acad Sci USA 1978 ; 75 : 5132–5136. [CrossRef] [Google Scholar]
- Geissmann F, Manz MG, Jung S, et al. Development of monocytes, macrophages, and dendritic cells. Science 2010 ; 327 : 656–661. [CrossRef] [PubMed] [Google Scholar]
- Swiecki M, Colonna M. Unraveling the functions of plasmacytoid dendritic cells during viral infections, autoimmunity, and tolerance. Immunol Rev 2010 ; 234 : 142–162. [CrossRef] [PubMed] [Google Scholar]
- Robbins SH, Walzer T, Dembélé D, et al. Novel insights into the relationships between dendritic cell subsets in human and mouse revealed by genome-wide expression profiling. Genome Biol 2008 ; 9 : R17. [CrossRef] [PubMed] [Google Scholar]
- Schlitzer A, McGovern N, Teo P, et al. IRF4 transcription factor-dependent CD11b+ dendritic cells in human and mouse control mucosal IL-17 cytokine responses. Immunity 2013 ; 38 : 970–983. [CrossRef] [PubMed] [Google Scholar]
- Villadangos JA, Shortman K. Found in translation: the human equivalent of mouse CD8+ dendritic cells. J Exp Med 2010 ; 207 : 1131–1134. [CrossRef] [PubMed] [Google Scholar]
- Lee J, Breton G, Oliveira TY, et al. Restricted dendritic cell and monocyte progenitors in human cord blood and bone marrow. J Exp Med 2015 ; 212 : 385–399. [CrossRef] [PubMed] [Google Scholar]
- Breton G, Lee J, Zhou YJ, et al. Circulating precursors of human CD1c+ and CD141+ dendritic cells. J Exp Med 2015 ; 212 : 401–413. [CrossRef] [PubMed] [Google Scholar]
- Zitvogel L, Amigorena S, Teillaud JL. À propos de Ralph M. Steinman et des cellules dendritiques. Med Sci (Paris) 2011; 27 : 1028–1103. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2015 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Développement des cellules dendritiques humaines. Le developpement des cellules dendritiques commence dans la moelle osseuse. Le progeniteur GMDP (granulocyte, monocyte and dendritic cell progenitor) se developpe en granulocytes et en un progeniteur commun aux cellules dendritiques et aux monocytes appele MDP (monocyte and dendritic cell progenitor). Le progeniteur MDP produit les monocytes ainsi qu’un progeniteur commun aux cellules dendritiques appele CDP (common DC progenitor). Le progeniteur CDP produit les cellules dendritiques plasmacytoides (pDC) ainsi qu’un precurseur immediat des cellules dendritiques conventionnelles appele pre-cDC (conventional dendritic cell precursor). Le precurseur pre-cDC est capable de migrer de la moelle osseuse vers les organes lymphoides secondaires via la circulation sanguine pour produire les deux sous-populations majeures de cellules dendritiques conventionnelles i.e. BDCA-1+ cDC et BDCA-3+ cDC. Le developpement des cellules dendritiques se fait sous le controle du recepteur du ligand de Flt3. Le developpement des monocytes se fait sous le controle du recepteur du M-CSF et est finalise dans la moelle osseuse ou un precurseur immediat des monocytes appele pre-mono (monocyte precursor) produit les monocytes. HSC : hematopoietic stem cells. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




