| Numéro |
Med Sci (Paris)
Volume 31, Numéro 5, Mai 2015
|
|
|---|---|---|
| Page(s) | 499 - 505 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20153105011 | |
| Publié en ligne | 9 juin 2015 | |
Les galectines
Des lectines pas comme les autres
Galectins, a class of unconventional lectins
1
Institut Jacques Monod, UMR 7592 CNRS, université Paris-Diderot, équipe morphogenèse, homéostasie et pathologies, 15, rue Hélène Brion, 75205
Paris Cedex 13, France
2
Équipe ingénierie moléculaire et glycobiologie, UMR CNRS 6286, unité fonctionnalité et ingénierie des protéines, faculté des sciences et techniques de Nantes, 2, rue de la Houssinière, BP 92208, 44322
Nantes Cedex 3, France
*
mireille.viguier@univ-paris-diderot.fr
Les galectines forment une famille de lectines animales solubles caractérisées par leur domaine de liaison aux sucres, conservé au cours de l’évolution, et leur affinité pour des glycoconjugués contenant des β-galactosides. Chaque galectine présente un profil d’expression spatio-temporelle, des ligands et des partenaires spécifiques. Ces lectines sont localisées en intra ou extracellulaire et modulent divers processus cellulaires, dont l’adhérence intercellulaire ou avec la matrice extracellulaire, l’organisation de domaines membranaires, la signalisation cellulaire, le trafic intracellulaire, l’apoptose et la régulation du cycle cellulaire. Les souris ayant une mutation nulle pour les galectines 1, 3 ou 7 sont viables, mais présentent des défauts multiples en condition de stress. La participation des galectines à ces multiples processus les désignent comme des cibles thérapeutiques de choix, en particulier dans les cancers et les maladies inflammatoires.
Abstract
Galectins constitute a family of soluble animal lectins defined by their evolutionary conserved carbohydrate recognition domain and their affinity for β-galactosides containing glycoconjugates. Each galectin is characterized by a specific spatio-temporal distribution and a unique set of ligands and molecular partners. Interestingly, galectins are found both extracellularly and intracellularly and modulate various cellular processes. Knock-out mutant mice for galectins-1, 3 or 7 are viable but display a wide range of defects under various stress conditions. Indeed, galectins are multifunctional proteins involved in cell-cell and cell-extracellular matrix interactions, organization of membrane domains, cell signalling and also in intracellular trafficking, apoptosis, regulation of cell cycle. Galectins represent potential therapeutic targets, especially in the context of cancer and inflammatory diseases.
© 2015 médecine/sciences – Inserm
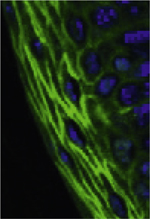
Vignette : image en microscopie confocale d’un immunomarquage en vert pour galectine 7 sur l’épiderme de souris C57Bl/6j et un marquage en bleu des noyaux au Hoechst (© Mireille Viguier).
Les galectines ont été décrites à l’origine comme étant impliquées précocement dans le développement. À partir des années 1980, leur rôle dans la progression tumorale a été étudié, puis, 10 ans plus tard, leur contribution dans la réponse immunitaire a été documentée. Aujourd’hui, on leur reconnaît de multiples fonctions - dans l’apoptose, l’adhérence, la migration, la polarité cellulaire et le trafic intracellulaire - sans qu’un mécanisme d’action unique et simple ne puisse être dégagé.
Cette famille de lectines animales solubles non glycosylées se caractérise par la présence d’au moins un domaine conservé impliqué dans la reconnaissance des sucres (domaine CRD [carbohydrate recognition domain]) et une affinité particulière pour les β-galactosides [1]. Les nombreuses données de la littérature traduisent la complexité de leurs modes d’action et de leur localisation subcellulaire. Par leurs caractéristiques originales, elles régulent différents édifices moléculaires de la membrane plasmique, du cytoplasme mais aussi du noyau. Ainsi, ces lectines de faible poids moléculaire sont localisées à la fois aux niveaux intra et extracellulaires, sous une forme soluble ou périmembranaire. Elles présentent une remarquable dynamique de redistribution entre ces différents compartiments, que ce soit au cours de l’activation, de la différenciation ou du cycle cellulaires. Dans l’organisme, la distribution spatiotemporelle de chaque galectine est différente. Certaines sont exprimées dans de nombreux tissus (c’est le cas des galectines 1, 3 et 9), d’autres ont une expression restreinte, comme la galectine 7 dans les épithéliums pluristratifiés, ou la galectine 4 dans l’épithélium digestif [2]. Les profils d’expression peuvent se chevaucher et plusieurs galectines sont exprimées dans un même tissu ; mais, dans ces cas de coexpression, leurs localisations subcellulaires sont distinctes.
Dans cette revue, nous présenterons l’évolution, la structure et la localisation subcellulaire des galectines. Nous décrirons en particulier certaines de leurs fonctions clés et montrerons en quoi leurs propriétés leur confèrent des potentialités thérapeutiques prometteuses dans des pathologies variées comme le cancer, l’inflammation et différentes maladies infectieuses.
Les galectines au cours de l’évolution
Des gènes codant pour des protéines de type galectine sont retrouvés depuis les protistes jusqu’aux mammifères ; chez ces derniers, quinze galectines ont été caractérisées. Il existe des similitudes de structure entre galectines et lectines d’origine végétale [3]. Le domaine CRD des galectines semble être apparu au cours de l’évolution, au moment de la mise en place des organismes multicellulaires. Ceci suggère un rôle des galectines, documenté aujourd’hui, dans la cohésion intercellulaire constitutive des tissus. De nombreux organismes possèdent plusieurs gènes codant des membres de cette famille. Certaines galectines existent même sous plusieurs isoformes, suggérant une diversification fonctionnelle. Le fait que cette famille génique est en rapide évolution est illustré par les différences de répertoire de galectines existant entre deux espèces proches de mammifères (comme la souris et le rat), mais également entre deux lignées de souris consanguines (souche C57Bl/6j et 129sv) [4].
Structure des galectines
Les galectines ont en commun un domaine de reconnaissance des carbohydrates qui forme un globule de 130 acides aminés comportant deux feuillets β antiparallèles de 5 et 6 brins. Sur les brins 4 et 6 du second feuillet, certains résidus forment un motif caractéristique de reconnaissance des β-galactosides (H49, N51, R53, N62, W69, E72, R74 ; selon l’architecture de la galectine 7) [5]. On distingue trois groupes parmi les galectines : (1) les galectines monovalentes, possédant un seul CRD (≈14 kDa) susceptible de se dimériser (galectines 1, 2, 5, 7, 10, 11, 13, 14) ; (2) les galectines divalentes, contenant deux CRD différents (≈30 kDa) liés par une courte séquence (galectines 4, 6, 8, 9, 12) ; et (3) le groupe dit chimérique, composé d’un unique membre, la galectine 3 (30 kDa), dont le CRD est associé à un domaine de même longueur riche en prolines et glycines, mais dépourvu d’affinité pour les sucres (Figure 1A).
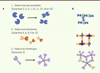 |
Figure 1. La famille des galectines. A. Classification des 3 sous-types de galectines et exemples d’oligomérisations homophiles. B. Exemples de pontages moléculaires induits par la liaison avec différents ligands. |
L’affinité des galectines pour les polysaccharides varie selon leur composition, la longueur des chaînes glycaniques, ainsi que la présence de branchements ou de modifications supplémentaires des structures glucidiques comme l’ajout d’acide sialique. Le cœur du site de liaison des carbohydrates contient sept résidus hautement conservés parmi les galectines. D’autres résidus, moins conservés, modifieraient la spécificité individuelle [5]. De manière générale, le disaccharide minimal reconnu par les galectines est le N-acétyl lactosamine (LacNac). Les galectines ont une affinité plus importante pour les N-glycanes. Par ailleurs, l’affinité pour les glycanes augmente en fonction du nombre de branchements et de répétitions de LacNac [6, 7]. Chaque galectine présente ainsi un spectre d’affinité caractéristique pour des groupements glycosylés complexes, suggérant des fonctions uniques et spécifiques.
Outre leur capacité à lier des glycoconjugués, plusieurs galectines sont capables de s’engager dans des interactions avec d’autres protéines, indépendamment des groupements glycosylés. Certaines galectines sont capables de s’oligomériser de manière homophile, par des interactions protéines-protéines [8, 9], même si la présence de ligands glycosylés peut favoriser leur association [10]. L’oligomérisation des galectines leur permet d’assurer leur fonctions d’organisatrices de complexes moléculaires (Figure 1B). Plusieurs galectines peuvent interagir avec d’autres ligands que des sucres. Par exemple, la galectine 1 se lie de façon directe avec la pseudo-chaîne légère des immunoglobulines durant le développement des lymphocytes B [11, 12]. Les galectines 10 et 11, dont seule une partie des résidus impliqués dans la liaison des sucres est conservée, ne sont plus capables de lier les β-galactosides, suggérant de possibles interactions protéines-protéines [13].
Localisation subcellulaire des galectines
L’essentiel de la littérature s’intéresse aux effets extracellulaires des galectines ; or celles-ci ne présentent ni peptide signal, ni glycosylation, et sont synthétisées sur des ribosomes libres avec une extrémité carboxy-terminale fréquemment acétylée. Les galectines sont sécrétées par des voies non classiques, et, dans le milieu extracellulaire, se localisent au niveau de la membrane plasmique ou de la matrice extracellulaire [14]. Les galectines sont cependant essentiellement présentes dans le cytoplasme et parfois dans le noyau [5], voire dans les mitochondries [15]. Certaines ont été détectées dans des fractions vésiculaires de la voie endocytique comme les exosomes des cellules dendritiques (galectine 3), ou les lysosomes des macrophages (galectine 1). En plus d’être sécrétées par une voie non classique, les galectines sont des acteurs du trafic intracellulaire. En effet, elles participent au trafic apical dans les cellules épithéliales en stabilisant les plates-formes de transport et en permettant le tri des glycoprotéines vers leur destination [14]. De plus, il a été montré récemment qu’elles intervenaient dans la biogenèse de certaines vésicules endocytiques indépendantes de la clathrine (galectines 3 et 4) [16]. Il faut souligner que nombre de leurs ligands extracellulaires sont glycosylés, au contraire de leurs ligands intracellulaires, qui, eux, seraient pour la plupart non glycosylés. Les rôles respectifs de ces contingents de galectines, soit intracellulaires, soit extracellulaires, ainsi que d’éventuelles régulations croisées, restent encore à élucider.
Fonctions des galectines
L’observation des modèles murins porteurs de mutations inactivatrices des gènes codant les galectines a permis de montrer que ces protéines sont, en particulier, des molécules d’adaptation au stress. En effet, ces souris déficientes sont viables, mais présentent des altérations de retour à l’homéostasie. Plusieurs galectines sont impliquées dans le recrutement des cellules immunitaires dans un foyer infectieux (voir ci-dessous). De plus, les galectines jouent un rôle central dans la réponse de l’organisme à une blessure. Ainsi, chez les souris dépourvues de galectine 7, on observe un retard de cicatrisation après une blessure et une prolifération anormale des kératinocytes après une exposition aux rayons UVB, indiquant que cette galectine intervient dans la réparation de l’épiderme [17]. De la même façon, la galectine 1 est impliquée dans la régénération musculaire déclenchée par une blessure induite par l’injection de cardiotoxine [18]. Plus généralement, certaines galectines auraient un rôle dans le maintien des cellules souches musculaires et neuronales. La galectine 1 intervient dans l’angiogenèse tumorale et, en son absence, la croissance tumorale est réduite, par défaut de néovascularisation [19]. Pour illustrer la diversité des fonctions biologiques des galectines, nous détaillons quelques exemples de processus dans lesquels elles interviennent (Figure 2).
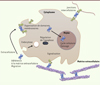 |
Figure 2. Différents mécanismes d’action des galectines |
Galectines et adhérence cellulaire
La forme extracellulaire de certaines galectines, qui se lie à des glycoconjugués, semble réguler l’organisation de la matrice extracellulaire et des molécules de surface impliquées dans l’adhérence cellulaire. Le modèle qui prévaut est celui d’un pontage entre des molécules de la matrice extracellulaire ou des récepteurs d’adhérence, mais surtout entre ces deux types de composants. De nombreux travaux ont ainsi montré le potentiel stabilisateur ou déstabilisateur de certaines galectines sur les interactions entre les cellules et la matrice extracellulaire. Ces pontages s’expliquent par la mutivalence des galectines ou leur capacité à s’organiser en multimères (Figure 1B). Ainsi, les trois groupes de galectines présentent des valences et des ligands variés. Par exemple, dans une lignée de tumeur mammaire murine, la galectine 3 peut déstabiliser la N-cadhérine et des composants des rafts au niveau des jonctions intercellulaires [20]. À l’inverse, dans un modèle de carcinome mammaire, un réseau de galectine 3 stabilise les contacts focaux et favorise la signalisation cellulaire [21]. La galectine 3 semble également favoriser la multimérisation de la hensine, une molécule de la matrice extracellulaire, au cours de la différenciation terminale des cellules épithéliales du rein [22].
La galectine 7, quant à elle, intervient dans le maintien de l’homéostasie de l’épiderme. Nous avons en effet montré en microscopie électronique dans un modèle de souris transgéniques surexprimant cette galectine, qu’au niveau de l’épiderme les jonctions adhérentes étaient affaiblies, ce qui est en accord avec la déstabilisation de la E-cadhérine [23].
Galectines et épissage des transcrits primaires
Les galectines 1 et 3 se localisent également dans le noyau des cellules. De façon surprenante, ces deux galectines fonctionneraient comme des facteurs d’épissage des pré-ARNm [5, 24, 25]. En effet, des extraits nucléaires de cellules HeLa dont on a éliminé les galectines 1 ou 3 présentent un épissage altéré [24, 25]. Ces deux galectines n’interagissent pas directement avec le pré-ARNm, mais plutôt avec la machinerie d’épissage. Ainsi, la galectine 3 s’associe à la ribonucléoprotéine U1 du spliceosome. De plus, les galectines 1 et 3 ségrègent dans des spliceosomes différents [26], ce qui suggère que leurs modes d’action pourraient être différents.
Il faut noter qu’il existe des formes mutantes de galectine-1 qui conservent leur fonction dans l’épissage, mais ont perdu la capacité de lier les saccharides, indiquant que cette fonction est indépendante de l’activité lectinique [26].
Galectines et immunité
Les galectines jouent un rôle dans au moins trois processus immunitaires : la reconnaissance des pathogènes, la régulation de la réponse immunitaire adaptative et la résolution de l’inflammation.
Les galectines extracellulaires reconnaissent des protéines glycosylées à la surface des cellules de l’hôte, mais elles peuvent également se lier à des polysaccharides contenant des β-galactosides présents à la surface des microorganismes, ou à des produits sécrétés par ces derniers. Elles peuvent donc être considérées comme de possibles PRR solubles (récepteurs de reconnaissance de motifs moléculaires partagés par les pathogènes). En effet, l’infection par certaines bactéries peut moduler le niveau d’expression des galectines, et la liaison des galectines à certains pathogènes peut les neutraliser ou avoir un effet bactéricide [27]. Par exemple, les galectines 4 et 8 sont capables de lyser certaines souches d’Escherichia coli [28], tandis que la galectine 3 favorise le recrutement de leucocytes sur le lieu de l’infection par Streptococcus pneumoniae [27, 29]. Il a également été rapporté que certaines galectines intracellulaires peuvent reconnaître des bactéries internalisées dans les cellules de l’hôte. Par exemple, la galectine 8 peut induire l’autophagie des vacuoles contenant des bactéries intracellulaires [27].
Outre ce rôle de senseur de l’infection par certains pathogènes, les galectines interviennent aussi à de multiples étapes de la réponse immunitaire et de l’inflammation [6]. Elles sont notamment capables de moduler la signalisation, l’activation, l’apoptose, ainsi que la sécrétion de cytokines par des lymphocytes T effecteurs [6]. Elles influent également sur la signalisation et la différenciation des lymphocytes B, et jouent un rôle dans la tolérance immunitaire en modulant les fonctions de lymphocytes T régulateurs (Treg). Plusieurs études ont ainsi montré que les galectines 1, 3, 4 et 9 étaient impliquées dans la suppression de l’inflammation chronique et de l’auto-immunité dans différents modèles animaux [6], anticipant de possibles applications thérapeutiques.
Galectines : des cibles thérapeutiques potentielles ?
La dérégulation de l’expression des galectines a pu être associée, directement ou indirectement, à plus de cent pathologies. Les galectines apparaissent donc aujourd’hui comme des cibles thérapeutiques potentielles ou, plus simplement, comme biomarqueurs dans les cancers ou les maladies cardiaques [30]. Dans le cancer, les galectines ont des capacités régulatrices de l’apoptose [15] en favorisant l’activation de mécanismes de survie en présence d’agents antitumoraux comme le cisplatine ou l’étoposide [31], et des voies de signalisation intracellulaire [6]. Elles jouent également un rôle essentiel dans l’invasion des cellules cancéreuses (adhérence et détachement de la matrice extracellulaire), les processus métastatiques (migration cellulaire), l’angiogenèse tumorale et l’immunité antitumorale (anergie des lymphocytes T) [32].
La découverte d’agents thérapeutiques actifs contre les galectines n’en est qu’à ses prémices. Pour être efficaces tout en limitant les effets secondaires, les drogues antigalectines devront être sélectives d’une ou de plusieurs galectines qui peuvent avoir des effets antagonistes, par exemple pro- ou anti-anoïkis 1 [33], voire être spécifiques de la forme extra ou intracellulaire d’une galectine. Leur action devra être locale plutôt que systémique, et les voies d’administration ou de ciblage appropriées.
Quelques molécules font déjà l’objet d’études cliniques (Tableau I, Figure 3) : ce sont des dérivés de polysaccharides naturels, des peptidomimétiques ou des mono ou disaccharides apparentés à des ligands naturels. Des approches alternatives, moins avancées, visent à proposer non pas des inhibiteurs, mais des mimes ou des versions tronquées des galectines capables d’entrer en compétition avec les galectines parentes et d’agir comme formes dominantes négatives.
Inhibiteurs des galectines en cours d’évaluation clinique.
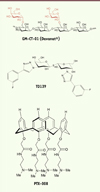 |
Figure 3. Structure de trois composés utilisés comme inhibiteurs des galectines. |
Polysaccharides naturels
Les polysaccharides naturels, tels que les pectines, les galacturonanes ou les galactomannanes, ont été les premiers composés à être proposés en tant qu’inhibiteurs potentiels des galectines. Tous ces polymères possèdent des taux variables de résidus galactose et/ou d’acide galacturonique susceptibles de se lier aux galectines. Ils sont disponibles à faible coût et, administrés par voie orale, faiblement métabolisés. En revanche, leur composition peut varier et la structure fine de ces polymères est difficilement accessible, exception faite de GM-CT-012. Du fait de son antériorité, cette famille d’inhibiteurs est celle qui a fait l’objet du plus grand nombre d’essais cliniques chez l’homme [34–37]. Les effets antitumoraux de ces polysaccharides ont été le plus souvent étudiés dans des cancers avancés, en association avec des anticorps monoclonaux (par exemple ipilimubab, un anti-CTLA-4), des inhibiteurs du protéasome (bortezomib), ou le 5-fluorouracile. Dans ces essais, ces polysaccharides semblent réguler la mort cellulaire et les résistances aux drogues. D’autres, par exemple le dérivé GR-MD-023, sont également testés dans les fibroses et contribuent à la diminution des marqueurs de l’inflammation, de la fibrose et de l’apoptose.
Peptidomimétiques
Cette classe de composés cible spécifiquement la galectine 1 et inhibe son activité proangiogénique. En effet, la galectine 1 est abondamment sécrétée par les tumeurs, et stimule les voies de signalisation impliquées dans la prolifération et la migration des cellules endothéliales nécessaires à la néovascularisation tumorale. Contrairement aux autres molécules en cours de développement, ces composés interfèrent avec des interactions protéines-protéines et ne ciblent pas le domaine de reconnaissance des sucres (CRD). Les inhibiteurs originels, identifiés sur la base d’un criblage de peptides mimant la structure de protéines proangiogéniques, sont maintenant remplacés par des peptidomimétiques, beaucoup plus stables [38].
Petites molécules dérivées de sucres
La troisième approche est une approche de drug discovery à partir de ligands ou de motifs naturels (galactose, lactosamine, etc.) reconnus par les galectines. L’introduction de pharmacophores4 sur des positions clés de ces ligands permet de créer des interactions supplémentaires avec les domaines de reconnaissance des sucres des galectines pour donner naissance à des inhibiteurs plus affins et plus spécifiques. Le dérivé TD139 a une affinité de l’ordre de 10 nM pour les galectines 1 et 3, supérieure à celle qui est observée pour les polymères naturels. Il n’est pas reconnu par les autres membres de la famille des galectines. TD139 est entré en phase clinique pour le traitement de la fibrose pulmonaire. Il exerce une double action : il bloque l’activation de la β-caténine induite par le TGF-β (transforming growth factor) à l’origine de la conversion des cellules épithéliales en myofibroblastes, et prévient la transition des macrophages M1, impliqués dans la phagocytose des cellules mortes et des protéines de différents tissus, en macrophages M2 qui contribuent à la conversion des fibroblastes en myofibroblastes [39].
Conclusion
Les galectines constituent une famille particulière de lectines animales, dont l’évolution fut rapide avec une forte diversification. Ce sont des protéines solubles non glycosylées, de faible poids moléculaire, ayant de multiples fonctions. Leur plasticité est remarquable et leur dynamique de redistribution cellulaire unique parmi les lectines. Ainsi, les galectines apparaissent comme des régulateurs du maintien de l’homéostasie tissulaire, en contribuant à l’établissement d’une réponse adaptée aux agressions de l’environnement.
Les galectines, parce qu’elles interviennent dans de multiples processus biologiques, sont des protéines importantes en biologie et en glycobiologie, mais aussi des cibles thérapeutiques de choix dans différentes pathologies : dans les maladies auto-immunes ou de l’inflammation, via leur action de régulateur du système immunitaire, dans le traitement des cancers, via leur interférence avec les processus de néoangiogenèse ou de survie des cellules tumorales.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les travaux de recherche des auteurs sont financés par l’Université Paris Diderot, le CNRS, le GEFLUC, l’ARC, la LNCC et la FRM.
Nous remercions Tien Dang pour l’assistance technique en immunohistologie.
Références
- Barondes SH, Castronovo V, Cooper DN, et al. Galectins: a family of animal beta-galactoside-binding lectins. Cell 1994 ; 76 : 597–598. [CrossRef] [PubMed] [Google Scholar]
- Leffler H, Carlsson S, Hedlund M, et al. Introduction to galectins. Glycoconj J 2004 ; 19 : 433–440. [CrossRef] [Google Scholar]
- Cooper DNW. Galectinomics: finding themes in complexity. Biochim Biophys Acta 2002 ; 1572 : 209–231. [CrossRef] [PubMed] [Google Scholar]
- Houzelstein D, Gonçalves IR, Orth A, et al. Lgals6, a 2-million-year-old gene in mice: a case of positive Darwinian selection and presence/absence polymorphism. Genetics 2008 ; 178 : 1533–1545. [CrossRef] [PubMed] [Google Scholar]
- Wang JL, Gray RM, Haudek KC, Patterson RJ. Nucleocytoplasmic lectins. Biochim Biophys Acta 2004 ; 1673 : 75–93. [CrossRef] [PubMed] [Google Scholar]
- Rabinovich GA, Toscano MA. Turning sweet on immunity: galectin-glycan interactions in immune tolerance and inflammation. Nat Rev Immunol 2009 ; 9 : 338–352. [CrossRef] [PubMed] [Google Scholar]
- Hirabayashi J, Hashidate T, Arata Y, et al. Oligosaccharide specificity of galectins: a search by frontal affinity chromatography. Biochim Biophys Acta 2002 ; 1572 : 232–254. [CrossRef] [PubMed] [Google Scholar]
- Yang RY, Hill PN, Hsu DK, Liu FT. Role of the carboxyl-terminal lectin domain in self-association of galectin-3. Biochemistry (Mosc) 1998 ; 37 : 4086–4092. [CrossRef] [Google Scholar]
- Morris S, Ahmad N, André S, et al. Quaternary solution structures of galectins-1, -3, and -7. Glycobiology 2004 ; 14 : 293–300. [CrossRef] [PubMed] [Google Scholar]
- Lepur A, Salomonsson E, Nilsson UJ, Leffler H. Ligand induced galectin-3 protein self-association. J Biol Chem 2012 ; 287 : 21751–21756. [CrossRef] [PubMed] [Google Scholar]
- Gauthier L, Rossi B, Schiff C. La galectine-1 est un ligand du récepteur des lymphocytes pré-B. Med Sci (Paris) 2003 ; 19 : 144–146. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Elantak L, Espeli M, Boned A, et al. Structural basis for galectin-1-dependent pre-B cell receptor (pre-BCR) activation. J Biol Chem 2012 ; 287 : 44703–44713. [CrossRef] [PubMed] [Google Scholar]
- Cummings RD, Liu FT. Galectins. In : Varki A, Cummings RD, Esko JD, et al., eds. Essentials of glycobiology (chapter 33). 2nd ed. Cold Spring Harbor (NY) : Cold Spring Harbor Laboratory Press, 2009. [Google Scholar]
- Delacour D, Koch A, Jacob R. The role of galectins in protein trafficking. Traffic 2009 ; 10 : 1405–1413. [CrossRef] [PubMed] [Google Scholar]
- Villeneuve C, Baricault L, Canelle L, et al. Mitochondrial proteomic approach reveals galectin-7 as a novel BCL-2 binding protein in human cells. Mol Biol Cell 2011 ; 22 : 999–1013. [CrossRef] [PubMed] [Google Scholar]
- Lakshminarayan R, Wunder C, Becken U, et al. Galectin-3 drives glycosphingolipid-dependent biogenesis of clathrin-independent carriers. Nat Cell Biol 2014 ; 16 : 595–606. [CrossRef] [PubMed] [Google Scholar]
- Gendronneau G, Sidhu SS, Delacour D, et al. Galectin-7 in the control of epidermal homeostasis after injury. Mol Biol Cell 2008 ; 19 : 5541–5549. [CrossRef] [PubMed] [Google Scholar]
- Georgiadis V, Stewart HJS, Pollard HJ, et al. Lack of galectin-1 results in defects in myoblast fusion and muscle regeneration. Dev Dyn 2007 ; 236 : 1014–1024. [CrossRef] [PubMed] [Google Scholar]
- Thijssen VL, Postel R, Brandwijk RJ, et al. Galectin-1 is essential in tumor angiogenesis and is a target for antiangiogenesis therapy. Proc Natl Acad Sci USA 2006 ; 103 : 15975–15980. [CrossRef] [Google Scholar]
- Boscher C, Zheng YZ, Lakshminarayan R, et al. Galectin-3 protein regulates mobility of N-cadherin and GM1 ganglioside at cell-cell junctions of mammary carcinoma cells. J Biol Chem 2012 ; 287 : 32940–32952. [CrossRef] [PubMed] [Google Scholar]
- Goetz JG, Joshi B, Lajoie P, et al. Concerted regulation of focal adhesion dynamics by galectin-3 and tyrosine-phosphorylated caveolin-1. J Cell Biol 2008 ; 180 : 1261–1275. [CrossRef] [PubMed] [Google Scholar]
- Hikita C, Vijayakumar S, Takito J, et al. Induction of terminal differentiation in epithelial cells requires polymerization of hensin by galectin-3. J Cell Biol 2000 ; 151 : 1235–1246. [CrossRef] [PubMed] [Google Scholar]
- Gendronneau G, Sanii S, Dang T, et al. Overexpression of galectin-7 in mouse epidermis leads to loss of cell junctions and defective skin repair. PLoS One 2015; 10 : e0119031. [CrossRef] [PubMed] [Google Scholar]
- Haudek KC, Spronk KJ, Voss PG, et al. Dynamics of galectin-3 in the nucleus and cytoplasm. Biochim Biophys Acta 2010 ; 1800 : 181–189. [CrossRef] [PubMed] [Google Scholar]
- Vyakarnam A, Dagher SF, Wang JL, Patterson RJ. Evidence for a role for galectin-1 in pre-mRNA splicing. Mol Cell Biol 1997 ; 17 : 4730–4737. [PubMed] [Google Scholar]
- Haudek KC, Patterson RJ, Wang JL. SR proteins and galectins: what’s in a name? Glycobiology 2010 ; 20 : 1199–1207. [CrossRef] [PubMed] [Google Scholar]
- Chen HY, Weng IC, Hong MH, Liu FT. Galectins as bacterial sensors in the host innate response. Curr Opin Microbiol 2014 ; 17 : 75–81. [CrossRef] [PubMed] [Google Scholar]
- Stowell SR, Arthur CM, Dias-Baruffi M, et al. Innate immune lectins kill bacteria expressing blood group antigen. Nat Med 2010 ; 16 : 295–301. [CrossRef] [PubMed] [Google Scholar]
- Nieminen J, St-Pierre C, Bhaumik P, et al. Role of galectin-3 in leukocyte recruitment in a murine model of lung infection by Streptococcus pneumoniae. J Immunol 2008 ; 180 : 2466–2473. [CrossRef] [PubMed] [Google Scholar]
- Hrynchyshyn N, Jourdain P, Desnos M, et al. Galectin-3: a new biomarker for the diagnosis, analysis and prognosis of acute and chronic heart failure. Arch Cardiovasc Dis 2013 ; 106 : 541–546. [CrossRef] [PubMed] [Google Scholar]
- Harazono Y, Nakajima K, Raz A. Why anti-Bcl-2 clinical trials fail: a solution. Cancer Metastasis Rev 2014 ; 33 : 285–294. [CrossRef] [PubMed] [Google Scholar]
- Newlaczyl AU, Yu LG. Galectin-3: a jack-of-all-trades in cancer. Cancer Lett 2011 ; 313 : 123–128. [CrossRef] [PubMed] [Google Scholar]
- Sanchez-Ruderisch H, Fischer C, Detjen KM, et al. Tumor suppressor p16 INK4a: downregulation of galectin-3, an endogenous competitor of the pro-anoikis effector galectin-1, in a pancreatic carcinoma model. FEBS J 2010 ; 277 : 3552–3563. [CrossRef] [PubMed] [Google Scholar]
- Chauhan D, Li G, Podar K, et al. A novel carbohydrate-based therapeutic GCS-100 overcomes bortezomib resistance and enhances dexamethasone-induced apoptosis in multiple myeloma cells. Cancer Res 2005 ; 65 : 8350–8358. [CrossRef] [PubMed] [Google Scholar]
- Clark MC, Pang M, Hsu DK, et al. Galectin-3 binds to CD45 on diffuse large B-cell lymphoma cells to regulate susceptibility to cell death. Blood 2012 ; 120 : 4635–4644. [CrossRef] [PubMed] [Google Scholar]
- Henderson NC, Mackinnon AC, Farnworth SL, et al. Galectin-3 expression and secretion links macrophages to the promotion of renal fibrosis. Am J Pathol 2008 ; 172 : 288–298. [CrossRef] [PubMed] [Google Scholar]
- Klyosov A, Zomer E, Platt D. DAVANAT® (GM-CT-01) and colon cancer: preclinical and clinical (phase I and II) studies. In : Klyosov AA, ed. Glycobiology and drug design, vol. 1102. Washington, DC : American Chemical Society, 2012 : 89–130. [CrossRef] [Google Scholar]
- Astorgues-Xerri L, Riveiro ME, Tijeras-Raballand A, et al. Unraveling galectin-1 as a novel therapeutic target for cancer. Cancer Treat Rev 2014 ; 40 : 307–319. [CrossRef] [PubMed] [Google Scholar]
- Mackinnon AC, Gibbons MA, Farnworth SL, et al. Regulation of transforming growth factor-β1-driven lung fibrosis by galectin-3. Am J Respir Crit Care Med 2012 ; 185 : 537–546. [CrossRef] [PubMed] [Google Scholar]
Liste des tableaux
Liste des figures
 |
Figure 1. La famille des galectines. A. Classification des 3 sous-types de galectines et exemples d’oligomérisations homophiles. B. Exemples de pontages moléculaires induits par la liaison avec différents ligands. |
| Dans le texte | |
 |
Figure 2. Différents mécanismes d’action des galectines |
| Dans le texte | |
 |
Figure 3. Structure de trois composés utilisés comme inhibiteurs des galectines. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




