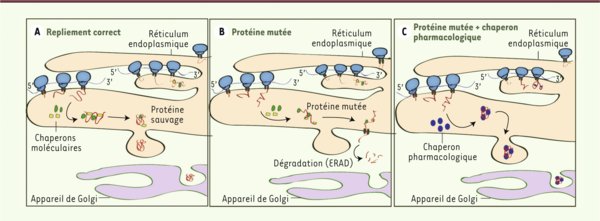
Figure 1.
Télécharger l'image originale
Mécanisme d’action des chaperons pharmacologiques. A. Durant la synthèse des protéines lysosomales, les chaperons moléculaires sont naturellement présents dans la cellule afin d’assister les polypeptides naissants à se replier correctement selon leur structure tertiaire. B. Les protéines lysosomales qui portent des mutations affectant leur repliement deviennent instables et sont dégradées par les systèmes de contrôle de qualité associés au réticulum endoplasmique (endoplasmic reticulum-associated degradation, ERAD). C. Les chaperons pharmacologiques stabilisent les protéines lysosomales mutantes mal repliées, empêchant leur dégradation par le protéasome et permettant leur trafic vers les lysosomes, où le pH acide est supposé favoriser la dissociation entre la molécule chaperon et l’enzyme, favorisant ainsi l’activité catalytique de cette dernière.
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




