Figure 2.
Télécharger l'image originale
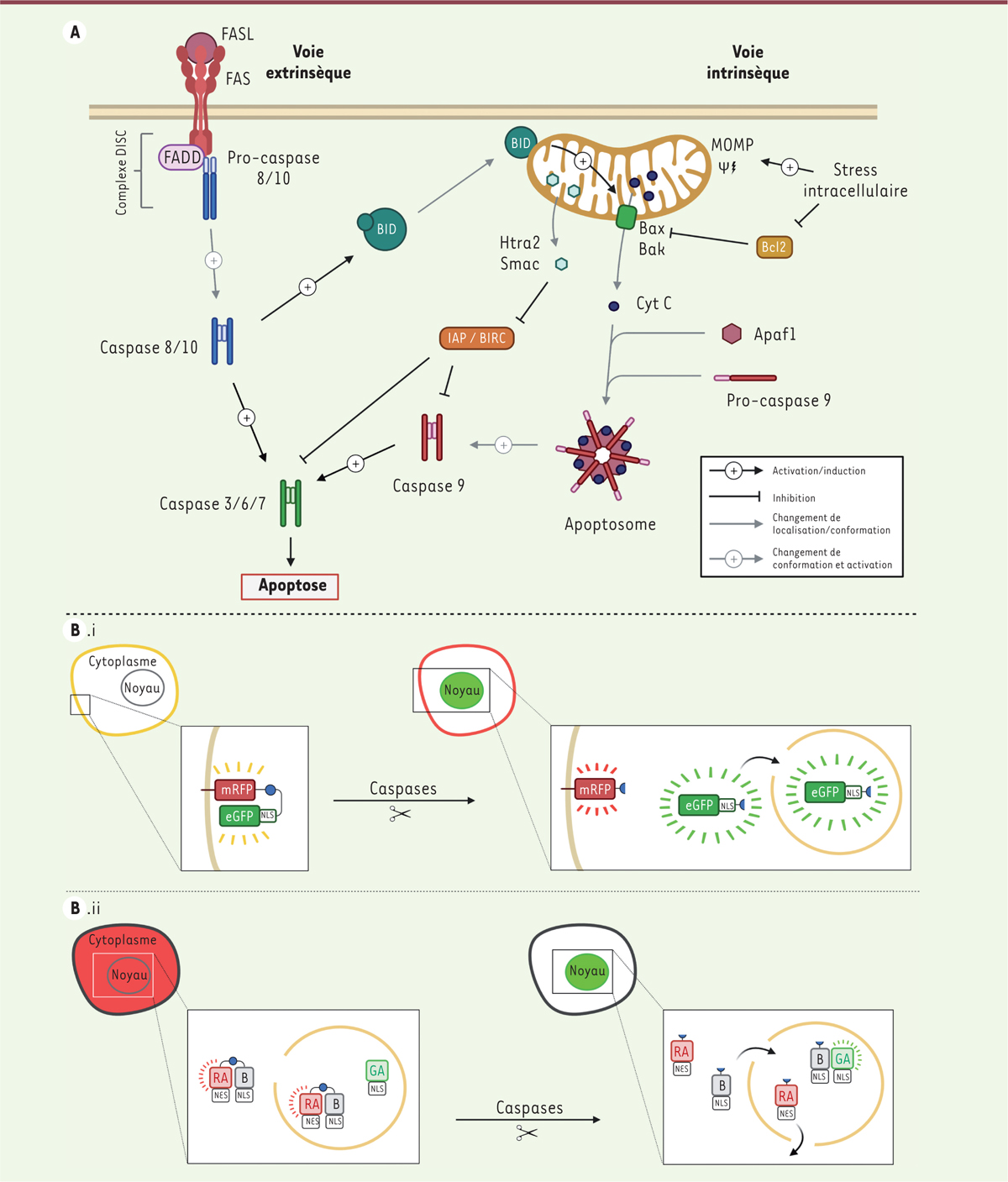
Voies d’induction de l’apoptose chez les mammifères et senseurs génétiques permettant son étude. (A) Les acteurs emblématiques de l’apoptose sont les caspases, dont on distingue deux types : les caspases initiatrices (8, 9, et 10 chez les mammifères), dotées d’un domaine spécifique permettant leur recrutement dans des complexes protéiques (voir ci-dessous), au sein desquels elles passent d’un état inactif (pro-caspase) à un état actif (caspase) en se coupant elles-mêmes (auto-clivage) ; les caspases effectrices (3, 6, 7 chez les mammifères), activées après leur coupure par les caspases initiatrices et induisant la mort de la cellule, en clivant elles-mêmes de nombreuses protéines (α-tubuline, DNases, etc.) [37]. La voie extrinsèque implique la fixation de ligands extracellulaires (comme FAS ligand : dérivé de FS-7-associated surface antigen) à des récepteurs de mort membranaires (comme FAS), provoquant le recrutement d’un complexe protéique appelé DISC (death-inducing signaling complex) constitué de FADD (FAS-associated proteins with death domains) et des caspases initiatrices sous leur forme inactive (pro-caspases). Ce recrutement permet l’activation des caspases 8/10, ce qui conduit à l’activation des caspases effectrices 3/6/7. Dans le cas de la voie extrinsèque, des signaux de stress intracellulaires conduisent à la perméabilisation de la membrane mitochondriale (MOMP : mitochondrial outer membrane permeabilization). Cette perméabilisation est gouvernée par l’action antagoniste de protéines de la famille Bcl2, pro-apoptotiques (Bax, Bak, Bid, Bok) et anti-apoptotiques (Bcl2, BCL2L1/2/3, BCL2A1). Plusieurs facteurs sont alors libérés dans le cytoplasme. Htra2 et Smac sont des inhibiteurs des protéines IAP/BIRC (inhibitors of apoptosis, aussi appelés baculoviral IAP repeat-containing protein), elles-mêmes inhibitrices de différentes caspases. Le cytochrome C, libéré via des canaux formés par Bax et Bak, s’associe à Apaf1 et à la pro-caspase 9 pour former l’apoptosome. Ce complexe permet le clivage de cette dernière en caspase 9, qui, à son tour, active les caspases 3, 6 et 7. Les deux voies ne sont pas indépendantes : ainsi les caspases 8/10, impliquées dans la voie extrinsèque, peuvent activer, en la clivant, la protéine pro-apoptotique BID, qui favorise la perméabilisation mitochondriale (schéma modifié d’après [38]). (B) Les senseurs génétiques, Apoliner (B.i) et FPX (échange de protéine fluorescente ou fluorescent protein exchange), (B.ii) permettent de mettre en évidence l’activité des caspases au sein des tissus vivants. (B.i) Le senseur Apoliner a été mis au point chez des embryons de drosophile et de poulet par Bardet et al. en 2008 [13]. Ce senseur comprend deux protéines fluorescentes différentes : mRFP (fluorescence rouge, protéine membranaire) et eGFP (fluorescence verte, protéine nucléaire du fait de la présence dans sa séquence d’un domaine de localisation nucléaire, NLS pour nuclear localisation signal), reliés par une séquence (disque bleu) reconnue et clivée par les caspases effectrices (séquence appelée CCS pour caspase cleavage sequence). En absence d’activité des caspases, le senseur est localisé à la membrane plasmique et y induit une fluorescence à la fois rouge et verte. La membrane apparait donc jaune. En cas d’activité des caspases, après le clivage de la CCS, les deux protéines fluorescentes se séparent l’une de l’autre. eGFP est transportée dans le noyau, y produisant une fluorescence verte, tandis que mRFP reste associée à la membrane, où l’on observe une fluorescence rouge. (B.ii) Le système FPX a été développé par Ding et al. en 2015 [14], en utilisant des cellules de mammifères en culture. Il est fondé sur l’emploi de protéines qui ne sont initialement pas fluorescentes (protéines GA et RA), mais qui le deviennent en s’associant à une autre protéine (protéine B). Le système repose sur la production dans les cellules de B et de RA qui sont liées l’une à l’autre par une séquence CCS (disque bleu), et de GA. Cette dernière, seule, n’est pas fluorescente, alors que RA, qui est associée à B, émet de la fluorescence rouge. Des séquences de localisation nucléaire NLS ou extranucléaire (NES, pour nuclear export sequence) positionnent la molécule non-fluorescente GA dans le noyau, tandis que le complexe RA-B fluorescent, rouge, est présent dans toute la cellule. C’est la situation qui est observée en absence d’activité des caspases. En présence de caspases actives, après le clivage de la séquence CCS, B va se dissocier de RA (qui ne va donc plus émettre de fluorescence) et s’associe à GA, présent dans le noyau. Le complexe GA-B émet alors de la fluorescence verte et le noyau devient donc vert.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




